Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
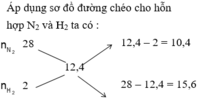
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : n N 2 n H 2 = 2 3
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn n N 2 = 2 m o l n H 2 = 3 m o l
nH2 pư = 3 . 40% = 1,2 mol,
n N2 phản ứng = 0,4 mol
n NH3 sinh ra =0,8 mol.
n Y = n X - 0 , 8 = 2 + 3 - 0 , 8 = 4 , 2 m o l
Bảo toàn khối lượng :
![]()
Vậy tỉ khối của Y với H2 là 7,38

Gọi \(\left\{{}\begin{matrix}n_{N_2}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\dfrac{28x+2y}{x+y}=12,4\)
\(\Leftrightarrow12,4x+12,4y-28x-2y=0\Leftrightarrow-15,6x=-10,4y\\ \Leftrightarrow\dfrac{x}{y}=-\dfrac{10,4}{-15,6}=\dfrac{2}{3}\)
Giả sử \(\left\{{}\begin{matrix}n_{N_2}=2\left(mol\right)\\n_{H_2}=3\left(mol\right)\end{matrix}\right.\)
\(n_{khí.giảm}=n_{NH_3}=\dfrac{2}{3}n_{H_2}.H\%=\dfrac{2}{3}.3.40\%=0,8\left(mol\right)\)
\(n_Y=2+3-0,8=4,2\left(mol\right)\)
\(m_Y=m_X=28.2+2.3=62\left(g\right)\)
\(\overline{M_Y}=\dfrac{62}{4,2}=14,76g/mol\)
\(n_{N_2}=a;n_{H_2}=b\\ PT:\dfrac{1}{2}N_2+\dfrac{3}{2}H_2-Fe,t^{^0}->NH_3\\ M_X=\dfrac{28a+2b}{a+b}=12,4\\ a=1,5b\\ Sau.pư:\\ M_Y=\dfrac{2.0,6b+28\left(a-\dfrac{0,4b}{3}\right)+17.0,4b}{0,6b+a-\dfrac{0,4b}{3}+0,4b}=19,55\)

\(\text{Đặt số mol N2 là 1 thì số mol H2 là 4 tổng số mol hỗn hợp X là 1 + 4 = 5}\)
Thay vào công thức
vì m sau = m trước
\(\text{Msau/M trước = n trước/ ( n trước - 2 nN2 phản ứng)}\)
\(\text{4,05 / 3,6 = 5/ (5- 2.nN2 phản ứng)}\)
\(\text{nN2 phản ứng = 0,278}\)
Thay M sau là 4,5 thì nN2 phản ứng là 0,5 mol, H = 50%.
Nếu đề M sau là 4,05 thì hiệu suất là 27,8%. ( đúng với thực tế).
Cách 2:
Giả sử ban đầu hỗn hợp có 1 mol trong đó có a mol N2 và b mol H2
\(\text{Ta có a + b =1 mol (1)}\)
\(\text{→28a+ 2y= 7,2 gam (2)}\)
Giải hệ gồm (1) và (2) suy ra x= 0,2 và y= 0,8
\(\text{N2+ 3H2 ⇌ 2NH3}\)
Do 0,8/3>0,2 nên hiệu suất tính theo N2
Đặt số mol N2 phản ứng là a mol
\(\text{ N2+ 3H2 ⇌ 2NH3}\)
Ban đầu 0,2..........0,8
Phản ứng a...........3a.............2a
Sau pứ (0,2-a).....(0,8-3a).........2a
Ta có
\(\text{(28x(0,2-a)+2x(0,8-3a)+2ax17)/(0,2-a+0,8-3a+2a)=9,1}\)
=>a=0,1
=>H=0,1/0,2=50%

Bài 16 :
Giả sử ban đầu có 1 mol X
Gọi số mol C2H4 và H2 là a và b
\(\left\{{}\begin{matrix}a+b=1\\\frac{28a+2b}{a+b}=4,25.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=1\\28a+2b=8,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,75\end{matrix}\right.\)
\(PTHH:C_2H_4+H_2\rightarrow C_2H_6\)
Trước ___0,25___ 0,75_________
Phứng___a___________________
Tỉ lệ : \(n_{C2H4}< n_{H2}\)
Hiệu suất tính theo C2H4
Gọi số mol C2H4 phản ứng là a
\(\frac{a}{0,25}=75\%\)
\(\Rightarrow a=0,1875\)
\(PTHH:C_2H_4+O_2\rightarrow C_2H_6\)
Trước _0,25_____0,75____________
Phứng_0,1875___ 0,1875_________
Sau____0,0625___ 0,5625___0,1875
Sau phản ứng, số mol hỗn hợp:
\(n=0,0625+0,5625+0,1875=0,8125\)
Khối lượng hỗn hợp:msau = m trước = 8,5
\(M_Y=\frac{8,5}{0,8125}=\frac{136}{13}\)
Tỉ khối so với H2 \(=\frac{136}{13}:2=5,28\)
Bài 17 :
Gọi công thức anken là CnH2n
Giả sử ban đầu nCnH2n = nH2 = 1mol
Số mol hỗn hợp ban đầu là 1 + 1 = 2
Gọi số mol phản ứng là a mol
\(PTHH:C_nH_{2n}+H_2\rightarrow C_nH_{2n+2}\)
Trước _____1______1____________
Phứng _____a______ a
Sau ______1 - a ____ 1 - a_________ a
Số mol hỗn hợp sau phản ứng=1 - a + 1 - a + a = 2 - a
\(\frac{M_B}{M_A}=1,6\)
\(\Rightarrow\frac{m_B:n_B}{m_A:n_A}=1,6\)
Mà khối lượng sau phản ứng không thay đổi
Hay mB = mA
\(\Rightarrow\frac{n_A}{n_B}=1,6\)
\(\frac{2}{2-a}=1,6\)
\(\Rightarrow a=0,75\)
Hiệu suất phản ứng: \(H=\frac{a}{1}=\frac{0,75}{1}=75\%\)
Bài 18 :
\(M_X=9,25.2=18,5\)
\(n_X=\frac{22,4}{22,4}=1\left(mol\right)\)
\(m_X=18,5.1=18,5\left(g\right)\)
Theo bảo toàn khối lương:
mX = mY = 18,5
\(M_Y=10.2=20\)
\(\Rightarrow n_Y=\frac{18,5}{20}=0,925\)
Ta có: n khí giảm chính là nH2 phản ứng
\(\Rightarrow n_{H2_{pư}}=1-0,925=0,075\left(mol\right)\)

\(\text{nX = 22,4:22,4 = 1 mol}\)
\(\text{nY = 20,16:22,4=0,9 mol}\)
Gọi số mol N2 phản ứng là x
\(\text{N2 + 3H2 ⇆2NH3}\)
\(\text{ x →3x → 2x}\)
Số mol khí Y là: 1-x-3x+2x=0,9
\(\text{ →x= 0,05 → nNH3 = 2.0,05=0,1 mol}\)
\(\text{AlCl3 + 3NH3 + 3H2O → Al(OH)3 ↓ +3NH4Cl}\)
\(\text{ 0,1 → 0,1/3}\)
\(\text{mAl(OH)3 = 0,1/3.27=0,9g}\)
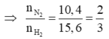


Chọn C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn n N 2 = 2 n H 2 = 3
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên : n Y = n x − 0 , 8 = 2 + 3 − 0 , 8 = 4 , 2 mol
Theo định luật bảo toàn khối lượng ta có : m Y = m x = m N 2 + m H 2 = 2 . 28 + 3 . 2 = 62 gam
Vậy M ¯ Y = m Y n Y = 62 4 , 2 = 14 , 76