Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1,
V1, N1 là thể tích, nồng độ of HCl
V2, N2 là thể tích, nồng độ of Na2CO3
Sử dụng công thức V1 N1 = V2 N2
==> N2 = 0.42 (N)
--> C = 0.21 (M)
--> m =0.6678 g. Vậy hàm lượng Na2CO3 là 0.6678g trong 2g ngậm nc.
2,
Pha dung dịch 0.1M: cần 10.6g Na2CO3 tinh khiết. Trong 2g muối thì có 0.6678g Na2CO3 --> cần dùng 35.3934g muối trên --> định mức 1L (1000ml)

Đáp án B
• 0,1a mol NaOH + 0,04 mol AlCl3 → ↓ Al(OH)3
Nung ↓ → 0,015 mol Al2O3
→ nAl(OH)3 = 0,03 mol.
• TH1: NaOH hết
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl
nNaOH = 0,03 × 3 = 0,09 mol
→ CMNaOH = 0,09 : 0,1 = 0,9 M.
• TH2: NaOH dư
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (*)
NaOH + Al(OH)3 → NaAlO2 + 2H2O (**)
Theo (*) nNaOH = 0,04 × 3 = 0,12 mol; nAl(OH)3 = 0,04 mol.
Theo (**) nAl(OH)3 phản ứng = 0,04 - 0,03 = 0,01 mol
→ nNaOH = 0,01 mol
→ ∑nNaOH = 0,12 + 0,01 = 0,13 mol
→ CMNaOH = 0,13 : 0,1 = 1,3 M


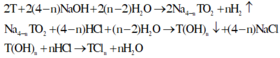
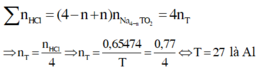

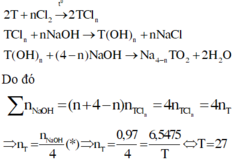




Trong 50 ml dd có 1 gam acid.
Ta có: \(n_{NaOH}=0,0327.0,5=0,01635\left(mol\right)\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH_3COOH\left(trong50ml\right)}=n_{NaOH}=0,01635\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH\left(trong50ml\right)}=0,01635.60=0,981\left(g\right)\)
\(\Rightarrow\%m_{CH_3COOH}=\dfrac{0,981}{1}.100\%=98,1\%\)