Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

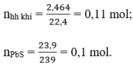
a) Phương trình hóa học của phản ứng:
Fe + 2HCl → FeCl2 + H2 (1)
FeS + 2HCl → FeCl2 + H2S (2)
H2S + Pb(NO3)2 → PbS + 2HNO3 (3)
b) Hỗn hợp khí thu được là H2 và H2S
Theo pt (3) ⇒ nH2S = nPbS = 0,1 mol
⇒ nH2 = nhh khí - nH2S = 0,11 – 0,1 = 0,01 mol
VH2 = 0,01 x 22,4 = 0,224l.
VH2S = 0,1 x 22,4 = 2,24l.
c) Theo PT (2) ⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1 × 88 = 8,8g.
Theo PT (1) nFe = nH2 = 0,01 mol ⇒ mFe = 56 × 0,01 = 0,56g.

Vì khí cho hỗn hợp khí vào dung dịch Pb(NO3)2 thì có kết tủa đen
⇒ Hỗn hợp khí có H2S và H2
Có nPbS = 23,9/239 = 0,1 mol
PTHH :
Pb(NO3)2 + H2S → PbS + 2HNO3
0,1 0,1 (Mol)
Fe + 2HCl → FeCl2 + H2
0,01 0,01 (Mol)
⇒ nFe = nH2 = 0,01 mol
⇒ mFe = 0,01.56 = 0,56 gam
FeS + 2HCl → FeCl2 + H2S
0,1 0,1 (Mol)
⇒ nFeS = nH2S = 0,1 mol
⇒ mFeS = 0,1.88 = 8,8 gam
=>VH2S=0,1.22,4=2,24l
%m FeS=\(\dfrac{8,8}{0,56+8,8}100\)=94,02%
=>%m Fe=5,98%
Chị lớp 12 giài bài 11 này đi: https://hoc24.vn/cau-hoi/bai-ankin-giup-mk-voi.5369779678773

a)ptpư : \(\text{FeS+2HCl→FeCl2+H2S}\)
\(x\) \(x\) (mol)
\(\text{ Fe+2HCl→FeCl2+H2}\)
\(y\) \(y\) (mol)
\(H2S+Pb\left(NO_3\right)_2\rightarrow2HNO_3+PbS\)
0,1mol \(n_{PbS}=\)\(\text{23,9/239=0,1mol}\)
\(\Rightarrow\) \(x\)\(\text{=0,1mol}\)
Mà : \(\text{x+y=4,48/22,4=0,2(mol)}\)
\(\Rightarrow\)\(\text{y=0,2−0,1=0,1(mol) }\)
Tự tính tỉ lệ nhé

a)Fe + 2HCl ->FeCl2 + H2\(\uparrow\)
0.01 0.01
FeS + 2HCl ->FeCl2 + H2S\(\uparrow\)
0.1 0.1
H2S + Pb(NO3)2->PbS \(\downarrow\) + 2HNO3
0.1 0.1
nPbS =2.39/239=0.1 mol , n (hỗn hợp khí) =2.464/22.4=0.11 mol
n(H2)+n(H2S)=0.11 ->n(H2)=0.01 mol
V(H2)=n * 22.4 = 0.01*22.4=0.224(l)
V(H2S)=n*22.4=0.1*22.4=2.24(l)
m(Fe)=n*M=0.01*56=0.56(g)
m(FeS)=n*M=0.1*88=8.8(g)

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\\ PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+3H_2\\ Đặt:n_{Al}=a\left(mol\right);n_{Fe}=b\left(mol\right)\left(a,b>0\right)\\ \Rightarrow\left\{{}\begin{matrix}27a+56b=11\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ a,n_{HCl}=2.n_{H_2}=2.0,4=0,8\left(mol\right)\\ \Rightarrow V_{ddHCl}=\dfrac{0,8}{8}=0,1\left(l\right)\\ b,FeCl_2+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2AgCl\downarrow\\ AlCl_3+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3AgCl\downarrow\\ n_{AgCl}=n_{AgNO_3}=3.n_{AlCl_3}+2.n_{FeCl_2}=3.a+2.b=3.0,2+2.0,1=0,8\left(mol\right)\\ \Rightarrow a=\dfrac{170.0,8}{250}.100=54,4\%\\ b=m_{\downarrow}=m_{AgCl}=0,8.143,5=114,8\left(g\right)\)

`Fe + 2HCl -> FeCl_2 + H_2 ↑`
`0,2` `0,2` `(mol)`
`FeS + 2HCl -> FeCl_2 + H_2 S↑`
`0,1` `0,1` `(mol)`
`H_2 S + Pb(NO_3)_2 -> PbS↓ + 2HNO_3`
`0,1` `0,1` `(mol)`
`n_[PbS] = [ 23,9 ] / 239 = 0,1 (mol)`
`n_Y = [ 6,72 ] / [ 22,4 ] = 0,3 (mol)`
`a)` Hỗn hợp `Y` gồm khí `H_2` và `H_2 S`
`=> n_[H_2 S] = 0,1 (mol)`
`=> n_[H_2] = 0,3 - 0,1 = 0,2 (mol)`
`b)m_[hh] = 0,2 . 56 + 0,1 . 88 = 20 (g)`

\(n_{PbS}=\dfrac{47,8}{239}=0,2\left(mol\right)\)
Bảo toàn S: \(n_{FeS}=n_{H_2S}=0,2\left(mol\right)\)
\(n_{H_2}=\dfrac{6,72}{22,4}-0,2=0,1\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<----------------------0,1
=> mFe = 0,1.56 = 5,6 (g)
mFeS = 0,2.88 = 17,6 (g)
\(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{5,6}{5,6+17,6}.100\%=24,138\%\\\%m_{FeS}=\dfrac{17,6}{5,6+17,6}.100\%=75,862\%\end{matrix}\right.\)

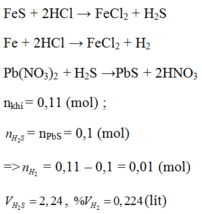

a) \(n_{PbS}=\dfrac{23,9}{239}=0,1\left(mol\right)\)
=> \(n_{H_2S}=0,1\left(mol\right)\)
\(\%V_{H_2S}=\dfrac{0,1.22,4}{2,464}.100\%=90,9\%\)
\(\%V_{H_2}=100\%-90,9\%=9,1\%\)
b) \(n_{H_2}=\dfrac{2,464.9,1\%}{22,4}=0,01\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,01<-------------------0,01
FeS + 2HCl --> FeCl2 + H2S
0,1<---------------------0,1
=> \(\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,01.56}{0,01.56+0,1.88}.100\%=5,983\%\\\%m_{FeS}=\dfrac{0,1.88}{0,01.56+0,1.88}.100\%=94,017\%\end{matrix}\right.\)