Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2}=\dfrac{2,24}{22,4}=0,1mol\)
\(2X+O_2\underrightarrow{t^o}2XO\)
\(\dfrac{13}{X}\) 0,1
\(\Rightarrow\dfrac{13}{X}=0,1\cdot2\Rightarrow X=65\)
Vậy X là kẽm Zn.
\(m_{ZnO}=0,2\cdot81=1,62g\)
\(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2R + O2 --to--> 2RO
0,2 0,.1
=> \(M_R=\dfrac{13}{0,2}=65\left(\dfrac{g}{mol}\right)\)
=> R: Zn

\(n_{O_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH : \(2X+O_2\underrightarrow{t^o}2XO\)
0,3 0,15 /mol
Ta có : \(0,3=\dfrac{19,2}{X}\Rightarrow X=64\) => X là Cu
\(m_{CuO}=80.0,3=24\left(g\right)\)
Gọi R là kim loại cần tìm.
\(n_{O_2}=\dfrac{3,36}{22,4}=0,15mol\)
\(2R+O_2\underrightarrow{t^o}2RO\)
\(\dfrac{19,2}{R}\) 0,15
\(\Rightarrow\dfrac{19,2}{R}=0,15\cdot2\Rightarrow R=64\Rightarrow Cu\)
Khối lượng oxit: \(m_{CuO}=0,3\cdot80=24g\)

\(2R+2nHCl\rightarrow2RCl_n+nH_2\)
.0,12/n...............0,12/n......0,06......
\(R_2O_n+2nHCl\rightarrow2RCl_n+nH_2O\)
.0,3/n......................................0,3....
\(n_{H_2O}=2n_{O_2}=0,3\left(mol\right)\)
Có : \(m=13,44=m_R+m_{R_2O_n}=\dfrac{0,12R}{n}+\dfrac{\left(2R+16n\right)0,3}{n}\)
\(\Rightarrow R=12n\)
=> R là Mg
\(n_{Al\left(I\right)}=\dfrac{3}{2}n_{H_2}=0,045\left(mol\right)\)
\(n_{Al\left(II\right)}=2n_{Al_2O_3}=\dfrac{2}{3}n_{H_2O}=\dfrac{2}{3}.2n_{O_2}=\dfrac{4}{3}n_{O_2}=\dfrac{1}{15}\left(mol\right)\)
\(\Rightarrow m_{Al}=m=3,015\left(g\right)\)

Đáp án A
* Xác định nguyên tố phi kim R:
+) Nếu hóa trị của R trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là ROn.
Khi đó công thức của hợp chất khí với hidro của R là RH8-2n. Theo giả thiết đề bài ta có:

| n |
1 |
2 |
3 |
| R |
8,72 |
37,22 |
65,72 |
Do đó trường hợp này có kết quả thỏa mãn.
+) Nếu hóa trị của R trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là R2On.
Khi đó công thức của hợp chất khí với hidro của R là RH8-n. Theo giả thiết đề bài ta có:
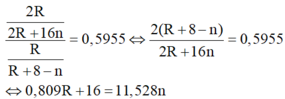
| n |
1 |
3 |
5 |
7 |
| R |
âm |
22,97 |
51,47 |
80 |
Do đó có n = 7 và R = 80 thỏa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là MBrx với x là hóa trị của M. Theo định luật bảo toàn khối lượng ta có:
![]() (gam)
(gam)
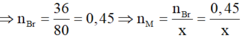
Mà 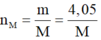 nên
nên 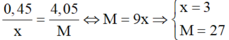 là Al.
là Al.
Do đó muối thu được là AlBr3.
Vậy phân tử khối của muối tạo ra là 27 + 80.3 = 267

Đáp án A
* Xác định nguyên tố phi kim R:
+) Nếu hóa trị của R trong oxit cao nhất là chẵn thì ta có công thức của oxit cao nhất là ROn.
Khi đó công thức của hợp chất khí với hidro của R là RH8-2n. Theo giả thiết đề bài ta có:

Do đó trường hợp này có kết quả thỏa mãn.
+) Nếu hóa trị của R trong oxit cao nhất là lẻ thì ta có công thức oxit cao nhất là R2On.
Khi đó công thức của hợp chất khí với hidro của R là RH8-n. Theo giả thiết đề bài ta có:

Do đó có n = 7 và R = 80 thỏa mãn.
Suy ra R là Br.
* Xác định kim loại M.
Vì Br trong hợp chất muối với kim loại có hóa trị I
Nên gọi công thức của muối thu được là MBrx với x là hóa trị của M. Theo định luật bảo toàn khối lượng ta có:
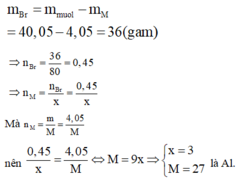
Do đó muối thu được là AlBr3.
Vậy phân tử khối của muối tạo ra là 27 + 80.3 = 267

PTHH:
\(M+H_2SO_4\rightarrow M_2\left(SO_4\right)_x+H_2\left(1\right)\)
\(M+O_2\rightarrow M_2O_x\left(2\right)\)
Phần 1:
\(n_{SO_4}=n_{H_2SO_4}=n_{H_2}=0,2\left(mol\right)\)
Ta có: \(m_{M_2\left(SO_4\right)_x}=m_M+m_{SO_4}\Leftrightarrow m_1=\dfrac{m}{2}+0,2.96=\dfrac{m}{2}+19,2\left(3\right)\)
Phần 2:
Ta có: \(m_O=m_{M_2O_x}-m_M=m_2-\dfrac{m}{2}\Rightarrow n_O=\dfrac{m_2}{16}-\dfrac{m}{32}\left(mol\right)\)
Lại có: \(n_{SO_4\left(1\right)}=x.n_{M_2\left(SO_4\right)_n}=\dfrac{x}{2}.n_M=x.n_{M_2O_x}=n_{O\left(2\right)}\)
\(\Leftrightarrow0,2=\dfrac{m_2}{16}-\dfrac{m}{32}\)
\(\Leftrightarrow3,2=m_2-\dfrac{m}{2}\)
\(\Leftrightarrow m_2=\dfrac{m}{2}+3,2\left(4\right)\)
Từ \(\left(3\right)\) và \(\left(4\right)\Rightarrow m_1-m_2=16\)

cho 6g một Kim loại R có hóa trị không đổi khi tác dụng với oxi tạo ra 10g oxit. Kim loại R là ?
Giải thích các bước giải:
6.0 gam R + O2 → 10 gam oxit
mO2 = 10 - 6 = 4 gam → nO2 = 0,125 mol
Theo bảo toàn e: n x nR = 0.125 X 4 → n x 6R6R = 0.5 → nRnR = 0.560.56 = 1212
Biện luận n = 2,R = 24 → Mg
⇒Kim loại R là:Mg
\(m_{O_2}=10-6=4\left(g\right)\Rightarrow n_{_{ }O_2}=0.125\left(mol\right)\)
\(4R+nO_2\underrightarrow{t^0}2R_2O_n\)
\(\dfrac{0.5}{n}...0.125\)
\(M_R=\dfrac{6}{\dfrac{0.5}{n}}=12n\)
\(n=2\Rightarrow R=24\)
\(Rlà:Mg\)