Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Gọi số mol của FeO và CuO lần lượt là x và y mol
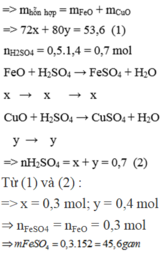
Ta có: m d d H 2 S O 4 = D . V = 1 , 2 . 500 = 600 g a m
Vì phản ứng không tạo ra chất khí hay kết tủa nên:
m d d s a u p ư = m t r ư ớ c p ư = m h h A + m d d a x i t = 53 , 6 + 600 = 653 , 6 g a m .
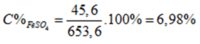

\(n_{FeO}=a\left(mol\right),n_{CuO}=b\left(mol\right)\)
\(m_{hh}=72a+80b=19.2\left(g\right)\left(1\right)\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(n_{H_2SO_4}=a+b=0.25\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):a=0.1,b=0.15\)
\(m_{FeO}=0.1\cdot72=7.2\left(g\right)\)
\(m_{CuO}=12\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.1}{0.25}=0.4\left(M\right)\)
\(C_{M_{CuSO_4}}=\dfrac{0.15}{0.25}=0.6\left(M\right)\)

n HCl = 360 x 18,25/(100x36,5) = 1,8 mol
H 2 + CuO → t ° Cu + H 2 O
n CuO = x
Theo đề bài
m CuO (dư) + m Cu = m CuO (dư) + m Cu p / u - 3,2
m Cu = m Cu p / u - 3,2 => 64x = 80x - 3,2
=> x= 0,2 mol → m H 2 = 0,4g
Fe + 2HCl → FeCl 2 + H 2
Số mol HCl tác dụng với Fe 3 O 4 , Fe 2 O 3 , FeO là 1,8 - 0,4 = 1,4 mol
Phương trình hóa học của phản ứng:
Fe 3 O 4 + 8HCl → 2 FeCl 3 + FeCl 2 + 4 H 2 O (1)
Fe 2 O 3 + 6HCl → 2 FeCl 3 + 3 H 2 O (2)
FeO + 2HCl → FeCl 2 + H 2 O (3)
Qua các phản ứng (1), (2), (3) ta nhận thấy n H 2 O = 1/2 n HCl = 1,4:2 = 0,7 mol
Áp dụng định luật bảo toàn khối lượng, ta có:
m hỗn hợp + m HCl = m muối + m H 2 O + m H 2
57,6 + 1,8 x 36,5 = m muối + 0,7 x 18 +0,4
m muối = 57,6 + 65,7 - 12,6 - 0,4 = 110,3 (gam)

a,\(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: x x
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: y y
Ta có: \(\left\{{}\begin{matrix}65x+56y=30,7\\x+y=0,5\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,3\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\%m_{Zn}=\dfrac{0,3.65.100\%}{30,7}=63,52\%;\%m_{Fe}=100\%-63,52\%=36,48\%\)
b,
PTHH: Zn + 2HCl → ZnCl2 + H2
Mol: 0,3 0,6
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4
nHCl = 0,6+0,4 = 1 (mol)
\(V_{ddHCl}=\dfrac{1}{2}=0,5\left(l\right)=500\left(ml\right)\)

Bài 6 :
a) Pt : \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O|\)
1 1 1 1
a 2a 0,2
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
b 3b 0,1
b) Gọi a là số mol của MgO
b là số mol của Al2O3
\(m_{MgO}+m_{Al2O3}=18,2\left(g\right)\)
⇒ \(n_{MgO}.M_{MgO}+n_{Al2O3}.M_{Al2O3}=18,2g\)
⇒ 40a + 102b = 18,2g
Ta có : \(m_{ct}=\dfrac{19,6.250}{100}=49\left(g\right)\)
\(n_{H2SO4}=\dfrac{49}{98}=0,5\left(mol\right)\)
⇒ 1a + 3b = 0,5 (2)
Từ (1),(2), ta có hệ phương trình :
40a + 102b = 18,2g
1a + 3b = 0,5
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{MgO}=0,2.40=8\left(g\right)\)
\(m_{Al2O3}=0,1.102=10,2\left(g\right)\)
d) Có : \(n_{MgO}=0,2\left(mol\right)\Rightarrow n_{MgSO4}=0,2\left(mol\right)\)
\(n_{Al2O3}=0,1\left(mol\right)\Rightarrow n_{Al2\left(SO4\right)3}=0,1\left(mol\right)\)
\(m_{MgSO4}=0,2.120=24\left(g\right)\)
\(m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\)
\(m_{ddspu}=18,2+250=268,2\left(g\right)\)
\(C_{MgSO4}=\dfrac{24.100}{268,2}=8,95\)0/0
\(C_{Al2\left(SO4\right)3}=\dfrac{34,2.100}{268,2}=12,75\)0/0
e) \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O|\)
2 1 1 2
1 0,5
\(n_{NaOH}=\dfrac{0,5.2}{1}=1\left(mol\right)\)
\(m_{NaOH}=1.40=40\left(g\right)\)
\(m_{ddnaOH}=\dfrac{40.100}{12}=333,33\left(g\right)\)
\(V_{ddNaOH}=\dfrac{333,33}{1,1}=303,2\left(ml\right)\)
Chúc bạn học tốt

\(n_{CuO}=x;n_{Fe_2O_3}=y\\ PTHH:CuO+2HCl\rightarrow CuCl_2+H_2O\\ PTHH:Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ hpt:\left\{{}\begin{matrix}80x+160y=24\\2x+6y=1.0,8\end{matrix}\right.\Leftrightarrow x=y=0,1\\ \rightarrow\left\{{}\begin{matrix}m_{CuO}=80.0,1=8\left(g\right)\\m_{Fe_2O_3}=160.0,1=16\left(g\right)\end{matrix}\right.\)
\(C_{M_{CuCl_2}}=\frac{0,1}{0,8}=0,125\left(M\right)\\ C_{M_{FeCl_3}}=\frac{0,2}{0,8}=0,25\left(M\right)\)
\(PTHH:Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(n_{H_2SO_4}=0,15\left(mol\right)\\ TL:\frac{0,1}{1}>\frac{0,15}{3}\rightarrow Oxit\cdot du\)
\(C\%_M=\frac{0,05.400}{16+100}.100\%=17,24\left(\%\right)\\ C\%_{Oxit\cdot du}=\frac{160.\left(0,1-0,05\right)}{16+100}.100\%=6,9\left(\%\right)\)


a, PT: \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
\(FeO+H_2SO_4\rightarrow FeSO_4+H_2O\)
Gọi: \(\left\{{}\begin{matrix}n_{CuO}=x\left(mol\right)\\n_{FeO}=y\left(mol\right)\end{matrix}\right.\) ⇒ 80x + 72y = 11,2 (1)
Ta có: \(n_{H_2SO_4}=0,15.1=0,15\left(mol\right)\)
Theo PT: \(n_{H_2SO_4}=n_{CuO}+n_{FeO}=x+y=0,15\left(2\right)\)
Từ (1) và (2) ⇒ x = 0,05 (mol), y = 0,1 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\dfrac{0,05.80}{11,2}.100\%\approx35,71\%\\\%m_{FeO}\approx64,28\%\end{matrix}\right.\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{CuSO_4}=n_{Cu}=0,05\left(mol\right)\\n_{FeSO_4}=n_{FeO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{CuSO_4}}=\dfrac{0,05}{0,15}=\dfrac{1}{3}\left(M\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,15}=\dfrac{2}{3}\left(M\right)\end{matrix}\right.\)