Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
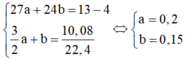
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

Đáp án B
Cho Al và Ag phản ứng với H 2 S O 4 loãng, dư chỉ có Al phản ứng.
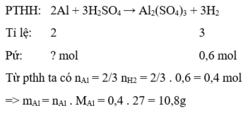
% m A l = 10,8 12 .100 % = 90 % .
% m A g = 100 % - 90 % = 10 %

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,4<-----------------------------------0,6
=> \(\%Al=\dfrac{0,4.27}{12}.100\%=90\%\)
%Ag = 100% - 90% = 10%

- Cu không tác dụng được với dd H2SO4 loãng.
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ n_{Zn}=n_{H_2}=0,1\left(mol\right)\\ \Rightarrow\%m_{Zn}=\dfrac{0,1.65}{10,5}.100\approx61,905\%\\ \Rightarrow\%m_{Cu}\approx38,095\%\)
anh giúp em bài này với https://hoc24.vn/cau-hoi/giup-minh-voi-trong-tam-giai-thich-ki-cai-de-nha-cam-on.2017646398420

a) PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
2 mol : 3 mol : 1 mol : 3 mol
0,1 mol <-- 0,15 mol <--- 0,15 mol
số mol của H2 là: 3,36 / 22,4 = 0,15 mol
khối lượng Al là: 0,1 * 27 = 2,7 g
ta có: 8 g chất rắn không tan sau phản ứng là: Cu
vậy khối lượng hỗn hợp a là: mAl + mCu = 2,7 + 8 = 10,7 g
b) khối lượng chất tan của H2SO4 là: mchất tan= 0,15 * 98 = 14,7 g
ta có: C% H2SO4= (mchất tan/ m dung dịch) * 100
→ m dung dịch H2SO4 = ( m chất tan * 100) / C% = ( 14,7 * 100) / 20= 73,5 g

a. PTHH:
\(Zn+H_2SO_4--->ZnSO_4+H_2\uparrow\)
\(Cu+H_2SO_4--\times-->\)
b. Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{Zn}=n_{H_2SO_4}=n_{H_2}=0,1\left(mol\right)\)
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{\dfrac{200}{1000}}=0,5M\)
c. Ta có: \(m_{Zn}=0,1.65=6,5\left(g\right)\)
\(\Rightarrow m_{Cu}=10,5-6,5=4\left(g\right)\)

Z n + H 2 S O 4 → Z n S O 4 + H 2
Cu không tác dụng với axit Sunfuric.
⇒ n Z n = n H 2 = 2,24/22,4 = 0,1 mol
⇒ m Z n = 0,1.65 = 6,5g
⇒ m C u = m r a n c o n l a i = 10,5 - 6,5 =4g
⇒ Chọn B.


Câu 2:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\\ n_{Al}=\dfrac{2.0,6}{3}=0,4\left(mol\right)\\ \%m_{Al}=\dfrac{0,4.27}{12}.100\%=90\%\Rightarrow\%m_{Ag}=100\%-90\%=10\%\)
Câu 3:
\(n_{H_2}=\dfrac{0,6}{2}=0,3\left(mol\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\\ n_{Al}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ n_{Al_2O_3}=\dfrac{25,8-0,2.27}{102}=0,2\left(mol\right)\\ n_{AlCl_3}=n_{Al}+2n_{Al_2O_3}=0,2+2.0,2=0,6\left(mol\right)\\ m_{AlCl_3}=133,5.0,6=80,1\left(g\right)\)