
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) 2 vật thể tự nhiên: cây cối, khí quyển
2 vật thể nhân tạo: bàn, ghế
b) Ta nói được: Ở đâu có vật thể ở đó có vật chất, bởi vì: chất là đơn vị cấu tạo nên vật thể
a)Vật thể tự nhiên: Động vật, núi,...
Vật thể nhân tạo: Nhà, bệnh viện,...
b) Vì chất có ở khắp mọi nơi

Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)


Mk làm nha. Nhưng lần sau bạn nhớ chép đề đấy:
Đề: Khí nitơ và khí oxi là hai thành phần chính của không khí. Trong kĩ thuật, người ta có thể hạ thấp nhiệt độ để hóa lỏng không khí. Biết nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC. Làm thế nào để tách riêng được khí oxi và khí nitơ từ không khí ?
Giải:
Hóa lỏng khí nitơ và khí oxi bằng cách làm lạnh đến -200 độ C rồi để nguội. Do ni-tơ có nhiệt độ sôi là -196 độ, nhỏ hơn khí ô-xi (-183 độ C) nên ni-tơ sẽ sói và bay hơi trước; khí ni- tơ được chưng cất trong một cái bình khác. Còn ô-xi do sôi sau nên khi khí ni-tơ bay hơi hết thì chỉ còn lại ô-xi lỏng. Vạy là ta đã tách được ô-xi và ni-tơ riêng.
Chúc bạnh học tốt!![]()

Bài 5: Cho sơ đồ của phản ứng như sau:
Al + CuSO4 → Alx(SO4)y + Cu
a) Xác định các chỉ số x và y.
b) Lập phương trình hóa học và cho biết tỉ lệ số nguyên tử của cặp đơn chất kim loại số phân tử của cặp hợp chất,
Bài 3: Canxi cacbonat là thành phần chính của đá vôi. Khi nung đá vôi xảy ra phản ứng hóa học sau:
Canxi cacbonat → Canxi oxit + cacbon đioxit.
Biết rằng khi nung 280kg đá vôi tạo ra 140kg canxi oxit CaO (vôi sống) và 110kg khí cacbon đioxit CO2.
a) Viết công thức về khối lượng của các chất trong phản ứng.
b) Tính tỉ lệ phần trăm về khối lượng canxi cacbonat chứa trong đá vôi.

a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Lượng chất CO2 cần dùng:
Theo phương trình phản ứng, để thu được một chất khí duy nhất là CO2 thì số mol các chất tham gia phản ứng phải theo đúng tỉ lệ của phương trình hóa học. Ta có:
=
=
= 10 mol

4.a)
nP=\(\dfrac{12,4}{31}\) 0,4 (mol).
n\(_{O_2}\)=\(\dfrac{17}{32}\)= 0,53 (mol).
PTHH :
4P + 5O2 → 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
4.b) Chất được tạo thành là P2O5 . Theo PTHH, ta có :
n\(_{P_2O_5}\)=\(\dfrac{1}{2}\)nP=12.0,4=0,2 (mol).
⇒m\(_{P_2O_5}\) = 0,2.(31.2 + 16.5) = 28,4(g)
5)PTHH:
C + O2 → CO2
12g 22,4(lít)
Khối lượng tạp chất lưu huỳnh và tạp chất khác là :
24. (0,5% + 1,5%) = 0,48kg = 480g.
Khối lượng cacbon nguyên chất là : 24 – 0,48 = 23,52 (kg) = 23520 (g).
Theo phương trình phản ứng, thể tích CO2 tạo thành là :
V\(_{CO_2}\)=\(\dfrac{23520}{12}\).22,4= 43904 (lít).
Phương trình phản ứng cháy của lưu huỳnh :
S + O2 → SO2
Khối lượng tạp chất lưu huỳnh là : 24.0,5% = 0,12 kg = 120 (g)
Theo phương trình phản ứng, thể tích khí SO2 tạo thành là :
V\(_{SO_2}\)=\(\dfrac{120}{32}.22,4\)=84 (l).

Điều kiện cần thiết cho một vật có thể cháy được và tiếp tục cháy được: chất phải nóng đến nhiệt độ cháy, phải đủ khí oxi cho sự cháy.
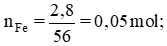
Nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC cho nên ta có thể tách riêng hai khí này bằng cách hạ thấp nhiệt độ để hóa lỏng không khí. Hóa lỏng không khí rồi nâng nhiệt độ xuống của không khí đến -196 oC, nitơ lỏng sôi và bay lên trước, còn oxi lỏng đến - 183 oC mới sôi, tách riêng được hai khí.