
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC cho nên ta có thể tách riêng hai khí này bằng cách hạ thấp nhiệt độ để hóa lỏng không khí. Hóa lỏng không khí rồi nâng nhiệt độ xuống của không khí đến -196 oC, nitơ lỏng sôi và bay lên trước, còn oxi lỏng đến - 183 oC mới sôi, tách riêng được hai khí.

a)
Gọi hợp chất đó là A
dh/chất/H2 = 81 =) MA = 81 x 2 = 162 (g/mol)
CTHH : CxHyNz
Khối lượng của mỗi nguyên tố có trong 1 mol khí A là :
mC = \(\frac{162\times74,07\%}{100\%}=119,9934\approx120\)
mN = \(\frac{162\times17,28\%}{100\%}=27,9936\approx28\)
mH = \(\frac{162\times8,64\%}{100\%}=13,9968\approx14\)
Số mol nguyên tử của mỗi nguyên tố trong 1mol khí A là
\(n_H=\frac{m}{M}=\frac{14}{1}=14\left(mol\right)\)
\(n_C=\frac{m}{M}=\frac{120}{12}=10\left(mol\right)\)
\(n_N=\frac{m}{M}=\frac{28}{14}=2\left(mol\right)\)
=) Trong 1 mol phân tử hợp chất A có : 14 nguyên tử H , 10 nguyên tử C và 2 nguyên tử N
CTHH là : \(C_{10}H_{14}N_2\)
b) Bạn tự làm nha =)))
Chúc bạn học tốt ![]()

Bài 1:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: nH2 = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: VH2= 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
Số mol của S tham gia phản ứng:
nS = 16/32 = 0,05 mol
Theo phương trình hóa học, ta có: nSO2 = nS = nO2 = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2= 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
VO2 = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5 VO2 = 5 . 1,12 = 5,6 lít
Bài 1 :
a) PTPU
Theo pt: nH2 = nFe = 0,05 (mol)
VH2 = 22,4.n = 22,4.0,05 = 1,12 (lít)
b) nHCl = 2.nFe = 2. 0,05 = 0,1 (mol)
mHCl = M.n = 0,1.36,5 = 3,65 (g)
Bài 2 :
a) Phương trình hóa học của S cháy trong không khí:
S + O2 to→→to SO2
b) Số mol của S tham gia phản ứng:
nS = 1,6321,632 = 0,05 mol
- Theo phương trình hóa học, ta có: nSO2nSO2 = nS = 0,05 mol
Thể tích khí sunfurơ sinh ra ở đktc là:
VSO2VSO2 = 22,4 . 0,05 = 1,12 (lít)
- Theo phương trình hóa học, ta có: nO2nO2 = nS = 0,05 mol
Thể tích khí oxi cần dùng ở đktc là:
VO2VO2 = 22,4 . 0,05 = 1,12 (lít)
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần dùng ở đktc là:
Vkk = 5VO2VO2 = 5 . 1,12 = 5,6 (lít)

1.
a. PTHH biểu diễn đơn giản PỨHH
gồm CTHH của chất phản ứng và chất sản phẩm
b. Sơ đồ phản ứng khác với PTHH ở điểm:
PTHH đã cân = số nguyên tử mỗi nguyên ti61, còn sơ đồ phản ứng chưa cân bằng số nguyên tử mỗi nguyên tố
c. Ý nghĩa củ PTHH: PTHH cho biết tỉ lệ về số nguyên tử, số phân tử giữa các chất cũng nư chưa từng cặp chất trong phản ứng.
2.
a. 4Na+O2->2Na2O. Tỉ lệ số nguyên tử, phân tử: 4:1:2
b. P2O5+2H2O->2H3PO4. Tỉ lệ số nguyên tử, phân tử: 1:3:2
3.
a. 2HgO->2Hg+O2. Tỉ lệ số phân tử, nguyên tử: 2:1:2:1
b. 2Fe(OH)3->Fe2O3+3H2O. Tỉ lệ số phân tử, nguyên tử: 2:1:3
4.
a. Na2CO3+NaCl2->CaCO3+2NaCl
5.
a. Mg+H2SO4->H2+MgSO4
6.
a. 4P+5O2-> 2P2O5
b. Tỉ lệ : 2:5
7.
a. 2Cu+O2->2CuO
b. Zn +2HCl->ZnXl2+H2
c. CaO+2HNO3->Ca(NO3)2+H2O
Bài 1
a) Phương trình hóa học là phương trình biểu diễn ngắn gọn phản ứng hóa học, gồm công thức hóa học của chất tham gia phản ứng và sản phẩm.
b) Sơ đồ phản ứng khác với phương trình hóa học là chưa có hệ số thích hợp, tức là chưa cân bằng số nguyên tử. tuy nhiên cũng có một số sơ đồ phản ứng cũng chính là phương trình hóa học
Ví dụ: Mg + Cl2 => MgCl2
c) Ý nghĩa: phương trình hóa học cho biết tỉ lệ số nguyên tử, số phân tử giữa các chất cũng như từng cặp chất trong phản ứng.
Bài 2
a) Phương trình hóa học: 4Na + O2 => 2Na2O.
Tỉ lệ: Số nguyên tử Na: số phân tử O2: số phân tử Na2O = 4 : 1 : 2.
b) Phương trình hóa học: P2O5 + 3H2O => 2H3PO4.
Tỉ lệ: Số phân tử P2O5 : số phân tử H2O : số phân tử H3PO4 = 1 : 3 : 2.
Bài 3
a) Phương trình hóa học: 2HgO ->2 Hg + O2
Tỉ lệ: Số phân tử HgO : số nguyên tử Hg : số phân tử O2 = 2 : 2 : 1
b) Phương trình hóa học: 2Fe(OH)3 - > Fe2O3 + 3H2O
Tỉ lệ: Số phân tử Fe(OH)3 : số phân tử Fe2O3 : số phân tử H2O = 2 : 1 : 3
Bài 4
a) Phương trình hóa học:Na2CO3+CaCl2→CaCO3+2NaCl
b) Ta có: 11 phân tử natri cacbonat và 11 phân tử canxi clorua tạo ra 11 phân tử canxi cacbonat và 22 phân tử natri clorua.
Tỉ lệ: Natri cacbonat : canxi clorua là 1:11:1
Canxi cacbonat : natri clorua là 1:21:2
Canxi clorua : natri clorua là 1:21:2
Natri cacbonat : canxi cacbonat là 1:11:1
Bài 5
a) Phương trình hóa học phản ứng:
Mg + H2SO4 -> H2 + MgSO4
b) Phân tử magie : phân tử axit sunfuric = 1 : 1
Phân tử magie : phân tử hidro = 1 : 1
Phân tử magie : phân tử magie sunfat = 1 : 1
Bài 6
a) Phương trình hóa học của phản ứng :
4P + 5O2 -> 2 P2O5
b) Tỉ lệ
Số phân tử P : số phân tử O2 : số phân tử P2O5 = 4 : 5 : 2
Bài 7
a) 2Cu+O2→2CuO
b) Zn+2HCl→ZnCl2+H2
c) CaO+2HNO3→Ca(NO3)2+H2O

2. Ba vật thể được làm bằng
a. Nhôm: soong, nồi, ấm
b. Thủy tinh: cốc, lọ, ống nghiệm
c. Chất dẻo: ghế, bàn, thước
3.
a. Vật thể: cơ thể người
Chất: nước
b. Vật thể: bút chì
Chất: than chì
c. Vật thể: dây điện
Chất: đồng, chất dẻo
d. Vật thể: áo
Chất: xenlulơz, nilon
e. Vật thể: xe đạp
Chất: sắt, nhôm, cao su
4.
| màu | vị | tính tan trong nước | tính cháy được | |
| muối ăn | trắng | mặn | có | không |
| đường | trắng | ngọt | có | có |
| than | đen | không | không | có |
5.Quan sát kĩ một chất chỉ có thể biết được (thể, màu...Dùng dụng cụ đo mới xác định được nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng của chất. Còn muốn biết một chất có tan trong nước, dẫn được điện hay không thì phải làm thí nghiệm
6. Nhận biết bằng cách: cắm ống hút vào nước vôi trong và thổi hơi vào đến khi nước vôi đục, từ đó ta nhận biết được khí này có trong hơi ta thở ra
7.
a. Giữa nước khoáng và nước cất:
- Hai tính chất giống nhau: đều trong suốt, thể lỏng
- Hai tính chất khác nhau:
+ Nước cất là chất tinh khiết; có thể pha chế được thuốc tiêm
+ Nước khoáng: là hỗn hợp; không thể pha chế được thuốc tiêm
b. Loại nước tốt hơn là nước khoáng vì nó có một số chất hòa tan có lợi cho cơ thể, nước cất uống có thể chậm tiêu hóa hơn so với nước khoáng.
8. Phương pháp tách: Hóa lỏng không khí ở nhiệt độ thấp (-183oC). Ta thu được khí oxi còn lại là nitơ
Bài 7 nè bạn:
a)* Giống: - Đều là chất lỏng
- Đều không màu, không mùi, không vị
* Khác:
b) uống nước khoáng tốt hơn


Mk làm nha. Nhưng lần sau bạn nhớ chép đề đấy:
Đề: Khí nitơ và khí oxi là hai thành phần chính của không khí. Trong kĩ thuật, người ta có thể hạ thấp nhiệt độ để hóa lỏng không khí. Biết nitơ lỏng sôi ở -196 oC, oxi lỏng sôi ở - 183 oC. Làm thế nào để tách riêng được khí oxi và khí nitơ từ không khí ?
Giải:
Hóa lỏng khí nitơ và khí oxi bằng cách làm lạnh đến -200 độ C rồi để nguội. Do ni-tơ có nhiệt độ sôi là -196 độ, nhỏ hơn khí ô-xi (-183 độ C) nên ni-tơ sẽ sói và bay hơi trước; khí ni- tơ được chưng cất trong một cái bình khác. Còn ô-xi do sôi sau nên khi khí ni-tơ bay hơi hết thì chỉ còn lại ô-xi lỏng. Vạy là ta đã tách được ô-xi và ni-tơ riêng.
Chúc bạnh học tốt!![]()

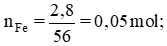
a) 2 vật thể tự nhiên: cây cối, khí quyển
2 vật thể nhân tạo: bàn, ghế
b) Ta nói được: Ở đâu có vật thể ở đó có vật chất, bởi vì: chất là đơn vị cấu tạo nên vật thể
a)Vật thể tự nhiên: Động vật, núi,...
Vật thể nhân tạo: Nhà, bệnh viện,...
b) Vì chất có ở khắp mọi nơi