Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có: nFe=5,656=0,1(mol)
nHCl=0,1.1=0,1(mol)
PT: Fe+2HCl→FeCl2+H2
Xét tỉ lệ: 0,11>0,12, ta được Fe dư.
a, Theo PT: nH2=12nHCl=0,05(mol)
⇒ VH2 = 0,05.22,4 = 1,12 (l)
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\\n_{HCl}=0,1\cdot1=0,1\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,1}{2}\) \(\Rightarrow\) Sắt còn dư, HCl p/ứ hết
\(\Rightarrow n_{Fe\left(dư\right)}=0,05\left(mol\right)=n_{FeCl_2}\) \(\Rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=0,05\cdot56=2,8\left(g\right)\\C_{M_{FeCl_2}}=\dfrac{0,05}{0,1}=0,5\left(M\right)\end{matrix}\right.\)

a)\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCL}=0,1.1=0,1\left(mol\right)\)
\(\Rightarrow n_{H_2}=2nH_2=2,0,1=0,2\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,2.22,4=4,48\left(ml\right)\)
b) sau pư Fe dư
ta có 1 molFe Pư 2 molHCL
0,05 molFe pư 0,1 HCL
\(\Rightarrow n_{Fe\left(dư\right)}:0,1-0,05=0,05\left(mol\right)\)
c)\(C_{MFeCL_2}=\dfrac{2.n_{HCL}}{0,1}=2M\)

\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(n_{H_2SO_4}=0.2\cdot2=0.4\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(1.........1\)
\(0.2..........0.4\)
\(LTL:\dfrac{0.2}{1}< \dfrac{0.4}{1}\Rightarrow H_2SO_4dư\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{H_2SO_4\left(dư\right)}=\left(0.4-0.2\right)\cdot98=19.6\left(g\right)\)
\(C_{M_{FeSO_4}}=\dfrac{0.2}{0.2}=1\left(M\right)\)

a) $CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O$
Theo PTHH :
$n_{CO_2} = n_{CaCO_3} = \dfrac{10}{100} = 0,1(mol)$
$V_{CO_2} = 0,1.22,4 = 2,24(lít)$
b) $n_{HCl} = 2n_{CaCO_3} = 0,2(mol)$
$C_{M_{HCl}} = \dfrac{0,2}{0,25} = 0,8M$
c) $CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$n_{CaCO_3} = n_{CO_2} = 0,1(mol)$
$m_{CaCO_3} = 0,1.100 = 10(gam)$

\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=2\cdot0,15=0,3\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên sau p/ứ Zn dư
\(\Rightarrow n_{Zn}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\\ \Rightarrow m_{Zn}=0,15\cdot65=9,75\\ \Rightarrow m_{Zn\left(dư\right)}=13-9,75=3,25\left(g\right)\\ c,n_{H_2}=n_{Zn}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)

a, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(n_{Fe}=n_{FeCl_2}=n_{H_2}=0,3\left(mol\right)\Rightarrow m_{Fe}=0,3.56=16,8\left(g\right)\)
b, \(n_{HCl}=2n_{H_2}=0,6\left(mol\right)\Rightarrow C_{M_{HCl}}=\dfrac{0,6}{0,15}=4\left(M\right)\)
c, \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\)
Theo PT: \(n_{NaOH}=2n_{FeCl_2}=0,6\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,6}{1}=0,6\left(l\right)=600\left(ml\right)\)
\(a.Fe+2HCl\rightarrow FeCl_2+H_2\\ n_{Fe,pư}=n_{FeCl_2}=n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\\ m_{Fe,pư}=0,3.56=16,8g\\ b.n_{HCl}=0,3.2=0,6mol\\ C_{M_{HCl}}=\dfrac{0,6}{0,15}=4M\\ c.2NaOH+FeCl_2\rightarrow Fe\left(OH\right)_2+2NaCl\\ n_{NaOH}=0,3.2=0,6mol\\ V_{ddNaOH}=\dfrac{0,6}{1}=0,6l=600ml\)

Bài 1 :
$n_{CO_2} = \dfrac{3,136}{22,4} = 0,14(mol)$
$n_{Ca(OH)_2} = 0,8.0,1 = 0,08(mol)$
CO2 + Ca(OH)2 → CaCO3 + H2O
0,08.......0,08...........0,08........................(mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
0,06........0,06........................................(mol)
Suy ra : $m_{CaCO_3} = (0,08 - 0,06).100 = 2(gam)$
Bài 2 :
$n_{CO_2} = \dfrac{2,24}{22,4} = 0,1(mol) ; n_{NaOH} = 0,1.1,5 = 0,15(mol)$
2NaOH + CO2 → Na2CO3 + H2O
0,15........0,075.......0,075....................(mol)
Na2CO3 + CO2 + H2O → 2NaHCO3
0,025........0,025...................0,05..............(mol)
Suy ra:
$C_{M_{NaHCO_3}} = \dfrac{0,05}{0,1} = 0,5M$
$C_{M_{Na_2CO_3}} = \dfrac{0,075 - 0,025}{0,1} = 0,5M$
b)
$NaOH + HCl \to NaCl + H_2O$
$n_{HCl} = n_{NaOH} = 0,15(mol)$
$m_{dd\ HCl} = \dfrac{0,15.36,5}{25\%} = 21,9(gam)$

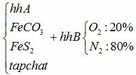
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
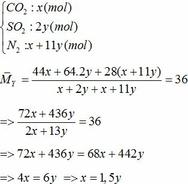
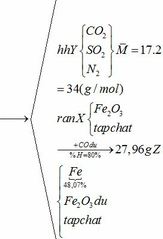
Khối lượng Fe có trong Z là:
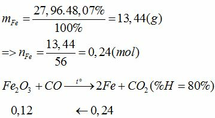
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
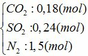
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
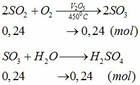
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
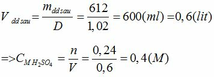


a)
$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol) ; n_{HCl} = 0,1.2 = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
Ta thấy :
$n_{Fe} : 1 > n_{HCl} : 2$ nên Fe dư
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,1(mol)$
$V_{H_2} = 0,1.22,4 = 2,24(lít)$
b)
$n_{Fe\ pư} = n_{H_2} = 0,1(mol)$
$\Rightarrow m_{Fe\ dư} = 11,2 - 0,1.56 = 5,6(gam)$
c)
$n_{FeCl_2} = n_{Fe\ pư} = 0,1(mol)$
$C_{M_{FeCl_2}} = \dfrac{0,1}{0,1} = 1M$
Bạn ơi cái chỗ nHCl= 0,1 . 2 = 0,2 mình ko hiểu cái 0,1 là ở đâu ạ mong bạn giải thích