Nếu trong một ngày thời gian nắng là 11 giờ thì 1m2 lá cây xanh khi quang hợp sẽ cần một lượng cacbonic và nhả ra môi trường một lượng khí oxi tỉ lệ với 11 và 8. Tính lượng cacbonic và lượng oxi mà 1m2 lá cây xanh đã thu vào và nhả ra, biết rằng lượng khí cacbonic nhiều hơn khí oxi là 6 gam
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Mặc dù quá trình quang hợp chỉ xảy ra ban ngày, còn quá trình hô hấp thì xảy ra cả ban ngày lẫn ban đêm nhưng do cường độ quang hợp nhanh và mạnh hơn nhiều so với hô hấp nên lượng khí oxi do quang hợp sinh ra cũng lớn hơn rất nhiều so với lượng khí cacbonic sinh ra trong quá trình hô hấp. Vì vậy, trồng cây giúp tăng cường khí oxi trong không khí

a)
\(C + O_2 \xrightarrow{t^o} CO_2\\ n_{CO_2} = n_{O_2} = \dfrac{6,4}{32} = 0,2(mol)\\ \Rightarrow m_{CO_2} = 0,2.44 = 8,8(gam)\)
b)
\(n_C = \dfrac{6}{12} = 0,5(mol)\\ n_{O_2} =\dfrac{19,2}{32} = 0,6(mol)\\ C + O_2 \xrightarrow{t^o} CO_2\)
\(n_C = 0,5 < n_{O_2} = 0,6 \Rightarrow\) Oxi dư.
\(n_{CO_2} = n_C = 0,5(mol)\\ \Rightarrow m_{CO_2} = 0,5.44 = 22(gam)\)

1) \(C+O_2\rightarrow CO_2\\
C+CO_2\rightarrow2CO\)
2)
\(pthh:C+O_2\rightarrow CO_2\)
=> số mol bằng nhau
\(n_{O_2}=\dfrac{6,4}{16}=0,4\left(mol\right)\)
áp vào pt trên ta có : nCO2 = 0,4 (mol)
=> \(m_{CO_2}=0,4.44=17,6\left(g\right)\)
=> dCO2/H2 = 44/2 = 22
dCO2/H2 = 44/2 = 22

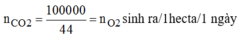


Gọi x, y(x,y>0;gam) là lượng khí cacbonic và oxi mà 1m2 lá cây xanh đã thu vào và nhả ra
Theo đề bài ta có:
x 11 = y 8 = x − y 11 − 8 = 6 3 = 2 ⇒ x = 22 ; y = 16
Vậy lượng khí cacbonic và oxi mà 1m2 lá cây xanh đã thu vào và nhả ra lần lượt là 22 gam và 6 gam