Cho 13 gam kẽm vào dụng dịch chứa 18,25 gam axit clohidric .
A, sau khi phản ứng kết thúc , chất nào còn dư và dư bao nhiêu gam
B, nếu nhím quỳ tím vào dung dịch sẽ phản ứng kết thúc thì có hiện tượng gì ?
C, tính thể tích khí H2 thu được sau phản ứng ở đktc.
D, cho toàn bộ khí H2 thu được ở trên đi qua 24 gam bột CuO đun nóng , sau phản ứng thu đc chất rắn A . Tính khối lượng chất rắn A

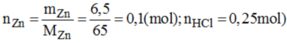
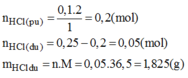

rồi mình đúng hay bạn đúng?
Vì CuO dư nên phải tính theo H2