Helps me !! Cần gấp lém @@
Một chất lỏng tạo bởi 3 nguyên tố là C, H, O. Đốt cháy hoàn 1,24g chất lỏng thì thu được 1,76 g CO2 và 1,08 g H2O.
a) Tính khối lượng C có trong 1,76 g CO2 .
b) Tính phần trăm khối lượng của C có trong hợp chất biết rằng lượng C có trong 1,76 g CO2 chính là lượng C có trong 1,24 g hợp chất.
c) Tính khối lượng H có trong 1,08 g H2O.
d) Tính phần trăm khối lượng của H có trong hợp chất biết rằng lượng H có trong 1,08 g H2O chính là lượng H có trong 1,24 g hợp chất.
e) Tính khối lượng của O có trong 1,24 g hợp chất.
f) Tính phần trăm khối lượng của O có trong hợp chất.
g) Tìm công thức hóa học của chất lỏng biết PTK của hợp chất bằng 62.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CTHH của hợp chất là: \(C_xH_yO_z\)
\(PTHH:2C_xH_yO_z+\dfrac{4x+y-2x}{2}O_2\overset{t^o}{--->}2xCO_2+yH_2O\)
Áp dụng định luật bảo toàn khối lượng, ta có:
\(m_{O_2}=1,08+1,76-1,24=1,6\left(g\right)\)
Ta có: \(m_{O_{\left(hc\right)}}=\dfrac{1,76}{44}.16.2+\dfrac{1,08}{18}.16-1,6=0,64\left(g\right)\)
\(m_{C_{\left(hc\right)}}=m_{C_{\left(CO_2\right)}}=\dfrac{1,76}{44}.12=0,48\left(g\right)\)
\(m_{H_{\left(hc\right)}}=1,24-0,48-0,64=0,12\left(g\right)\)
\(\Rightarrow x:y:z=\dfrac{0,48}{12}:\dfrac{0,12}{1}:\dfrac{0,64}{16}=0,04:0,12:0,04=1:3:1\)
Vậy CTHH của hợp chất là: \(CH_3O\)

Ta có: nCO2 = 1,76 : 44= 0,04 (mol)
nH2O = 1,08 : 18 = 0,06 (mol)
Sơ đồ pư : hợp chất + O2 -> CO2 + H2O
Áp dụng định luật bảo toàn nguyên tố:
nC/hợp chất = nC/CO2 = nCO2 = 0,04 ( mol)
nH/hợp chất = nH/H20 = 2nH2O = 2 . 0,06 = 0,12 (mol)
=> mC/hợp chất = 0,04 . 12 =0,48(g)
mH/hợp chất = 0,12 . 1 = 0,12 (g)
=> %mC/hợp chất = 0,48/1,24 . 100% = 38,71%
%mH/hợp chất = 0,12/1,24 . 100% = 9,68%
=> %mO/hợp chất = 100% - 38,71% - 9,68% = 51,61%
Gọi CTHH của hợp chất là CxHyOz
Ta có x:y:z = \(\dfrac{\%m_C}{M_C}:\dfrac{\%m_H}{M_H}:\dfrac{\%m_O}{M_O}\)
= \(\dfrac{38,71\%}{12}:\dfrac{9,68\%}{1}:\dfrac{51,61\%}{16}\)
= 3,23 : 9,68 : 3,23
= 1 : 3 : 1
=> CTHH của hợp chất là \(CH_3O\)
=> CTPT của hợp chất là \(\left(CH_3O\right)_a\)
mà PTK = 62
=> ( 12 + 1.3 + 16)a =62
=> a=2
Vậy CTPT của hợp chất là \(C_2H_6O_2\)

nCO2 = 0,03 mol → nC = nCO2 = 0,03 mol
nH2O = 0,06 mol → nH = 2nH2O = 0,12 mol
mN = 1,8.46,67% = 0,84 gam → nN = 0,84/14 = 0,06 mol
→ mO = mA - mC - mH - mN = 1,8 - 0,03.12 - 0,12 - 0,06.14 = 0,48 gam
→ nO = 0,48/16 = 0,03 mol
→ C : H : O : N = 0,03 : 0,12 : 0,03 : 0,06 = 1 : 4 : 1 : 2
→ CTPT có dạng (CH4ON2)n
Mà N trong 1 mol A ít hơn N trong 100 gam NH4NO3 nên ta có:
2n < 2.(100/80) → n < 1,25
→ n = 1
→ CTPT là CH4ON2 hay (NH2)2CO
Tên gọi của A là ure

Câu 2 :
a)
\(n_{CO_2} = \dfrac{0,3.10^{23}}{6.10^{23}} = 0,05(mol)\\ n_{O_2} = \dfrac{0,9.10^{23}}{6.10^{23}} = 0,15(mol)\)
Vậy :
\(\%n_{CO_2} = \dfrac{0,05}{0,15+0,05}.100\% = 25\%\\ \%n_{O_2} = 100\% - 25\% = 75\%\)
b)
Sục hỗn hợp vào dung dịch Ca(OH)2 lấy dư,thu lấy khí thoát ra ta được O2.Lọc dung dịch,thu lấy kết tủa
\(Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O\)
Cho kết tủa vào dung dịch HCl lấy dư, thu lấy khí thoát ra. Ta thu được khí CO2
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O\)

Khi A tác dụng với O 2 chỉ sinh ra, và H 2 O , vậy A có chứa cacbon, hiđro, có thể có hoặc không có oxi.
Theo định luật bảo toàn khối lượng :
m C O 2 + m H 2 O = m A + m O 2 = 7,30 (g) (1)
Theo đầu bài: m C O 2 + m H 2 O = 3,70(g). (2)
Từ hệ (1) và (2), tìm được m C O 2 = 5,50 g; m H 2 O = 1,80 g.
Khối lượng C trong 5,50 g
C
O
2
: 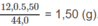
Khối lượng H trong 1,8 g
H
2
: 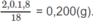
Đó cũng là khối lượng c và H trong 2,50 g chất A. Vậy chất A phải chứa O.
Khối lượng O trong 2,50 g A: 2,50 - 1,50 - 0,200 = 0,80 (g)
Phần trăm khối lượng của C: 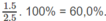
Phần trăm khối lương của H: 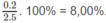
Phần trăm khối lương của O: 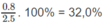

\(n_{CO_2}=\dfrac{3,84}{24}=0,16\left(mol\right)\Rightarrow n_C=0,16\left(mol\right)\\n_{H_2O}=\dfrac{3,6}{18}=0,2\left(mol\right)\Rightarrow n_H=0,4\left(mol\right)\\ n_{N_2}=\dfrac{0,96}{24}=0,04\left(mol\right)\Rightarrow n_N=0,08\left(mol\right)\\m_O=3,44-\left(0,16.12+0,4.1+0,08.14\right)=0\\ \Rightarrow AkhôngchứaO\\ VậyAđượctạobởicácnguyêntố:C,H,N \)

\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn C: nC = 0,2(mol)
Bảo toàn H: nH = 0,6 (mol)
=> \(n_O=\dfrac{4,6-0,2.12-0,6}{16}=0,1\left(mol\right)\)
=> \(\left\{{}\begin{matrix}\%C=\dfrac{0,2.12}{4,6}.100\%=52,174\%\\\%H=\dfrac{0,6.1}{4,6}.100\%=13,043\%\\\%O=\dfrac{0,1.16}{4,6}.100\%=34,783\%\end{matrix}\right.\)

A + O2 --> CO2 + H2O
nCO2 = \(\dfrac{13,2}{44}\)= 0,3 mol = nC
nH2O = \(\dfrac{5,4}{18}\)= 0,3 mol => nH = 0,3 .2 = 0,6 mol
nO2 = 6,72/22,4 = 0,3 mol
Áp dụng định luật BTKL : mA + mO2 = mCO2 + mH2O
=> mA = 13,2 + 5,4 - 0,3.32 = 9 gam
mC + mH = 0,3.12 + 0,6 = 4,2 < 9
=> Trong A có C ; H và O
mO = mA - mC - mH = 4,8 gam
%mC = \(\dfrac{0,3.12}{9}\).100% = 40% %mH = \(\dfrac{0,6}{9}\).100% = 6,67%
=>%mO = 100 - 40 - 6,67 = 53,33%
b) nO = \(\dfrac{4,8}{16}\)= 0,3 mol
Gọi CTĐGN của A là CxHyOz => x : y : z = nC : nH : nO = 1:2:1
=> CTPT của A có dạng (CH2O)n
MA = 1,0345.29 = 30 g/mol
=> n = 1 và CTPT của A là CH2O
Bài 2 :
nC = nCO2 = \(\dfrac{3,52}{44}\)= 0,08 mol ; nN = 2nN2 = \(\dfrac{0,448.2}{22,4}\)= 0,04 mol
nH = 2nH2O = 0,2 mol
Gọi CTĐGN của A là CxHyNt
=> x : y : t = nC : nH : nN = 2 : 5 : 1
CTPT của A có dạng (C2H5N)n
mà 1,29 gam A có thể tích = 0,96 gam oxi ở cùng đk
=> 1,29 gam A có số mol = 0,96 gam oxi ở cùng đk = \(\dfrac{0,96}{32}\)=0,03 mol
=> MA = \(\dfrac{1,29}{0,03}\)= 43 g/mol
=> (12.2 + 5 + 14)n = 43 <=> n = 1 và A có CTPT là C2H5N

nCO2= 1.76/44=0.04 mol
nH2O= 1.08/18=0.06 mol
a) nC(trong CO2) = nCO2 = 0.04 mol
=> mC(trong CO2) =0.04*12=0.48g
b) %mC = \(\dfrac{0.48}{1.24}\cdot100\) = 38.41%
c) nH=nH2O =0.06 mol
mH= 0.06*2 =0.12 g
d) %mH= \(\dfrac{0.12}{1.24}\cdot100\) = 9.68%
e) mO = mhợp chất -( mH +mO) = 1.24-(0.48+0.12) = 0.64g
%mO= \(\dfrac{0.64}{1.24}\cdot100\) =51.61%
f) Gọi công thức đơn giản nhất của hợp chất là CxHyOz
nC= 0.04 mol
nH=0.12 mol
nO=0.04 mol
Ta có : x:y:z = 0.04 : 0.12: 0.04 =1:3:1
Suy ra, công thức đơn giản nhất của hợp chất là CH3O
Gọi công thức phân tử của hợp chất là : (CH3O)n
PTKhợp chất = (12+3+16)n=62
=>n= 2
Vậy CTPT của hợp chất là C2H6O2 (etylen glicol)
Nếu bạn chưa học tới hóa học hữu cơ, ko biết CTPT thì viết C2H6O2 là CTHH cx đc :)