Đun nóng hỗn hợp gồm 0,65 gam bột Kẽm với 0,224 gam bột Lưu huỳnh trong ống nghiệm đậy kín không có không khí.
a/ Sau phản ứng thu được chất nào? Tính khối lượng của chúng?
b/ Nếu đun hỗn hợp trên ngoài không khí, tính khối lượng các chất thu được?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n Zn = 0,65/65 = 0,01 mol; n S = 0,224/32 = 0,007 mol
Zn + S → ZnS (1)
Theo (1) sau phản ứng trong ống nghiệm thu được:
n ZnS = 0,007 mol
m ZnS = 0,007x97 = 0,679 (g)
n Zn dư = (0,01 - 0,007) = 0,003 mol
m Zn dư = 65.0,003 = 0,195g

nZn=0,01, nS=0,007Zn+S→ZnS0,007 0,007 0,007
Sau phản ứng có 0,007 mol ZnS và 0,003mol Zn dư
ủa! trong H24 HOC24 có chữ màu ak??????
hồi giờ mik hk piết ak

\(n_S=\frac{0,224}{32}=0,007mol\)
\(n_{Zn}=\frac{0,650}{65}=0,01mol\)
\(n_S\)\(<\)\(n_{Zn}\)
\(\rightarrow\) chất dư là Zn, số mol của pt tính theo S:
Zn + S \(\rightarrow\) ZnS
0,007 0,007 0,007 ( mol )
Sau pư chất thu được trong ống nghiệm là: Zn dư ; ZnS
\(n_{Zn\left(dư\right)}=0,01-0,007=0,003\left(mol\right)\)
\(m_{ZnS}=0,007.97=0,697\left(g\right)\)
\(m_{Zn\left(dư\right)}=0,003.65=0,195\left(g\right)\)

https://hoc24.vn/hoi-dap/question/578153.html
mình đã giải ở đó rồi

nZn = mol, nS =
mol.
Phương trình hóa học của phản ứng:
Zn + S -> ZnS
0,07 0,07 0,07 (mol)
Khối lượng các chất sau phản ứng:
mZn(dư) = (0,01 -0,007).65 = 0,195 gam.
mZnS = 0,007.97 = 0,679g.

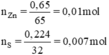
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S  ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
nZn = 0,65 / 65 = 0,01 mol.
nS = 0,224 /32 = 0,007 mol.
Phương trình hóa học của phản ứng
Zn + S →to ZnS
nZn phản ứng = 0,07 mol.
nZnS = 0,07 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.
a)
$n_{Zn} = 0,01(mol) ; n_{S} =0,007(mol)$
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} > n_S$ nên Zn dư
$n_{ZnS} = n_{Zn\ pư} = n_S = 0,007(mol)
Sau phản ứng :
$m_{ZnS} = 0,007.97 = 0,679(gam)$
$m_{Zn\ dư} = (0,01 - 0,007).65 = 0,195(gam)$
b)
2Zn + O2 \(\xrightarrow{t^o}\) 2ZnO
0,01.................0,01........(mol)
S + O2 \(\xrightarrow{t^o}\) SO2
0,007................0,007..............(mol)
Sau phản ứng :
$m_{ZnO} = 0,01.81 = 0,81(gam)$
$m_{SO_2} = 0,007.64 = 0,448(gam)$