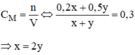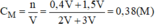A là dung dịch H2SO4 0,2M; Blaf dung dịch H2SO4 0,5M.
Trộn A và B theo tỉ lệ thể tích: VA:VB=2:1 được dung dịch C. Xác định nồng độ mol của dung dịch C. lấy V1 lit dung dịch HCl 0,6M trộn với V2 lit dung dịch NaOH 0,4M. Thu được dung dịch A(tổng V1+V2 =0.6l). biết 0,6l dung dịch A hoàn tan vừa đủ 0,02 mol Al2O3. Tính V1;V2.