Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong phòng thí nghiệm, quá trình điều chế khí Z thường bị lẫn SO2 nên Z là C2H4.
Vậy để tách SO2 ra khỏi hỗn hợp C2H4 và SO2 ta có thể dùng các chất: Ca(OH)2, K2SO3.
PTHH:
SO2 + Ca(OH)2 → CaSO3↓ + H2O
K2SO3 + SO2 + H2O → 2KHSO3

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2
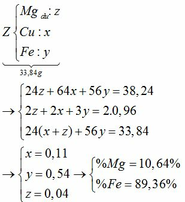

a, Ta có: \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
\(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PT: \(Zn+S\underrightarrow{t^o}ZnS\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,05}{1}\), ta được Zn dư.
Theo PT: \(n_{Zn\left(pư\right)}=n_{ZnS}=n_S=0,05\left(mol\right)\)
\(\Rightarrow n_{Zn\left(dư\right)}=0,3-0,05=0,25\left(mol\right)\)
- Chất rắn A gồm Zn dư và ZnS.
PT: \(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
_____0,05___0,1________________0,05 (mol)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,25____0,5__________0,25 (mol)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{H_2S}=\dfrac{0,05.22,4}{\left(0,05+0,25\right).22,4}.100\%\approx16,67\%\\\%V_{H_2}\approx83,33\%\end{matrix}\right.\)
b, \(V_{HCl}=\dfrac{0,1+0,5}{0,5}=1,2\left(l\right)\)

a. - Trích mẫu thử: Lấy ở mỗi lọ một lượng nhỏ ra ống nghiệm để nhận biết.
- Lấy dung dịch Na2CO3 cho vào mỗi ống trên:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được BaCl2.
BaCl2 + Na2CO3 \(\rightarrow\) BaCO3 \(\downarrow\)+ 2NaCl.
+ Có khí bay lên Þ Nhận biết được HCl:
2HCl + Na2CO3 \(\Rightarrow\) 2NaCl + CO2 + H2O.
+ Hai ống nghiệm không có hiện tượng gì chứa NaCl và Na2SO4.
- Dùng BaCl2 vừa nhận biết được ở trên cho vào hai mẫu chứa NaCl và Na2SO4:
+ Xuất hiện kết tủa trắng \(\Rightarrow\) Nhận biết được Na2SO4.
Na2SO4 + BaCl2 \(\rightarrow\) BaSO4\(\downarrow\) + 2NaCl.
+ Còn lại là NaCl.
b. Khi sục khí cacbonic vào dung dịch Ba(OH)2 đến dư, ban đầu xuất hiện kết tủa trắng, sau tan dần.
CO2 + Ba(OH)2 \(\rightarrow\) BaCO3\(\downarrow\) + H2O
CO2 + BaCO3 + H2O \(\rightarrow\) Ba(HCO3)2.
* Cho từ từ dung dịch HCl đến dư vào dung dịch NaOH loãng có chứa một lượng nhỏ phenolphtalein: dung dịch có màu hồng, sau nhạt dần đến mất hẳn.
HCl + NaOH \(\rightarrow\) NaCl + H2O.

CTHH: XaYb (X,Y có thể hoán vị)
Giả sử a = 2; b = 1
CTHH X2Y
Có: 2pX + pY = 10
- Với pX = 1 => pY = 8
=> X là H, Y là O
=> A là H2O
- Với pX = 2 => pY = 6
=> X là He, Y là C (Loại)
- Với pX = 3 => pY = 4
=> X là Li, Y là Be (Loại)
- Với pX = 4 => pY = 2
=> X là Be, Y là He (Loại)
Vậy A là H2O



Trả lời:
Sở dĩ các khí hiếm không có hợp chất và vì số electron ở lớp ngoài cùng là 8 (hoặc là 2 đối với heli), nên khó nhận thêm electron để liên kết với nó được. Tuy nhiên trong những điều kiện đặc biệt chỉ có vài hợp chất, điển hình như Heli hiđrua - HeH, agon florohiđrua - HArF, agoni ArH, xenon monoclorua XeCl...
~HT~