Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Trộn 200ml dd HCl 1M với 200ml dd H2SO4 1M thu được 400ml dd A. Tính nồng độ mol mỗi chất trong dd A

200ml = 0.2 (l), 400 ml = 0.4 (l)
Trong 200ml dung dịch HCl 1M:
nHCl = CM.V = 0.2 x 1 = 0.2 (mol)
Trong 200ml dung dịch H2SO4 1M
nH2SO4 = CM . V = 0.2 x 1 = 0.2 (mol)
Trong 400ml dung dịch A:
CM dd HCl = n/V = 0.2/0.4 = 0.5M
CM dd H2SO4 = n/V = 0.2/0.4 = 0.5M

áp dụng quy tắc đường chéo
0,3l dd H2SO4 2M-----------------x-1 (M)
------------------------- x(M)
0,2l dd H2SO4 1M------------------2-x (M)
trong đó x là nồng độ mol của dd H2SO4 THU ĐƯỢC
=> \(\dfrac{0,3}{0,2}=\dfrac{3}{2}=\dfrac{x-1}{2-x}\)
giải PT=> x=1,6 (M)
+) Ta có: \(V_{ddH_2SO_4\left(1\right)}=300\left(ml\right)=0,3\left(l\right)\\ V_{ddH_2SO_4\left(2\right)}=200\left(ml\right)=0,2\left(l\right)\)
=> \(n_{H_2SO_4\left(1\right)}=0,3.2=0,6\left(mol\right)\\ n_{H_2SO_4\left(2\right)}=0,2.1=0,2\left(mol\right)\)
=> Nồng độ mol của dung dịch H2SO4 sau trộn:
\(C_{MddH_2SO_4\left(mới\right)}=\dfrac{0,6+0,2}{0,3+0,2}=1,6\left(M\right)\)

a/ta có n(1)NaCl=0,2mol. ADCT:n=CM*Vdd. n(2)NaCl=1*0,2=0,2mol
Tổng mol của Na(1)và Na(2):
0,2+0,2=0,4mol
Vdd=0,2:1=0,2
---->CM=0,4/0,2=2(M)
b/
300mlKCl 0,4 C-1,2
CM
200mKCl 1,2. 0,4-C
300/200=C-1,2/0,4-C
-->CM=0,72(M)

ta có: nNaOH= 0,3. 1= 0,3( mol)
nH2SO4= 1,5. 0,2= 0,3( mol)
PTPU
2NaOH+ H2SO4----> Na2SO4+ 2H2O
0,3.................................0,15............
theo PTPU ta có: nH2SO4= \(\dfrac{1}{2}\)nNaOH= 0,15( mol)< 0,3 mol
=> H2SO4 dư NaOH hết
dd sau phản ứng là 0,15 mol Na2SO4 và 0,15 mol H2SO4
=> CM Na2SO4= \(\dfrac{0,15}{0,3+0,2}\)= 0,3M
CM H2SO4= \(\dfrac{0,15}{0,3+0,2}\)= 0,3M

nHCl = 1 . 0,2 = 0,2 mol
nBa(OH)2 = 1 . 0,2 = 0,2 mol
Pt: Ba(OH)2 + 2HCl --> BaCl2 + H2O
........0,1.............0,2...........0,1
Xét tỉ lệ mol giữa Ba(OH)2 và HCl:
\(\dfrac{0,2}{1}>\dfrac{0,2}{2}\)
Vậy Ba(OH)2 dư
V dd sau pứ = 0,2 + 0,2 = 0,4 mol
CM Ba(OH)2 dư = \(\dfrac{\left(0,2-0,1\right)}{0,4}=0,25M\)
CM BaCl2 = \(\dfrac{0,1}{0,4}=0,25M\)

Ta có: \(\text{nHNO3=0,2.1=0,2 mol}\)
\(\text{nHCl=0,3.0,5=0,15 mol}\)
\(\text{nAgNO3=0,25.1=0,25 mol}\)
Cho X tác dụng với AgNO3
HCl + AgNO3\(\rightarrow\) AgCl kt + HNO3
Vì nAgNO3 > nHCl nên AgNO3 dư
\(\rightarrow\) nAgCl=nHCl=0,15 mol \(\rightarrow\)\(\text{m=0,15.(108+35,5)=21,525 gam}\)
Sau phản ứng dung dịch chứa HNO3 và AgNO3 dư
nHNO3=0,2+nHNO3 mới tạo ra\(\text{=0,2+0,15=0,35 mol}\)
nAgNO3 dư=0,25-0,15=0,1 mol
V dung dịch sau phản ứng\(\text{=0,2+0,3+0,25=0,75 lít}\)
CM HNO3=\(\frac{0,35}{0,75}\)=0,467M;
CM AgNO3 dư=\(\frac{0,1}{0,75}\)=0,1333M
nNaOH=nHNO3 + nAgNO3\(\text{=0,35+0,1=0,45 mol}\)
\(\rightarrow\) V NaOH=\(\frac{0,45}{0,5}\)=0,9 lít
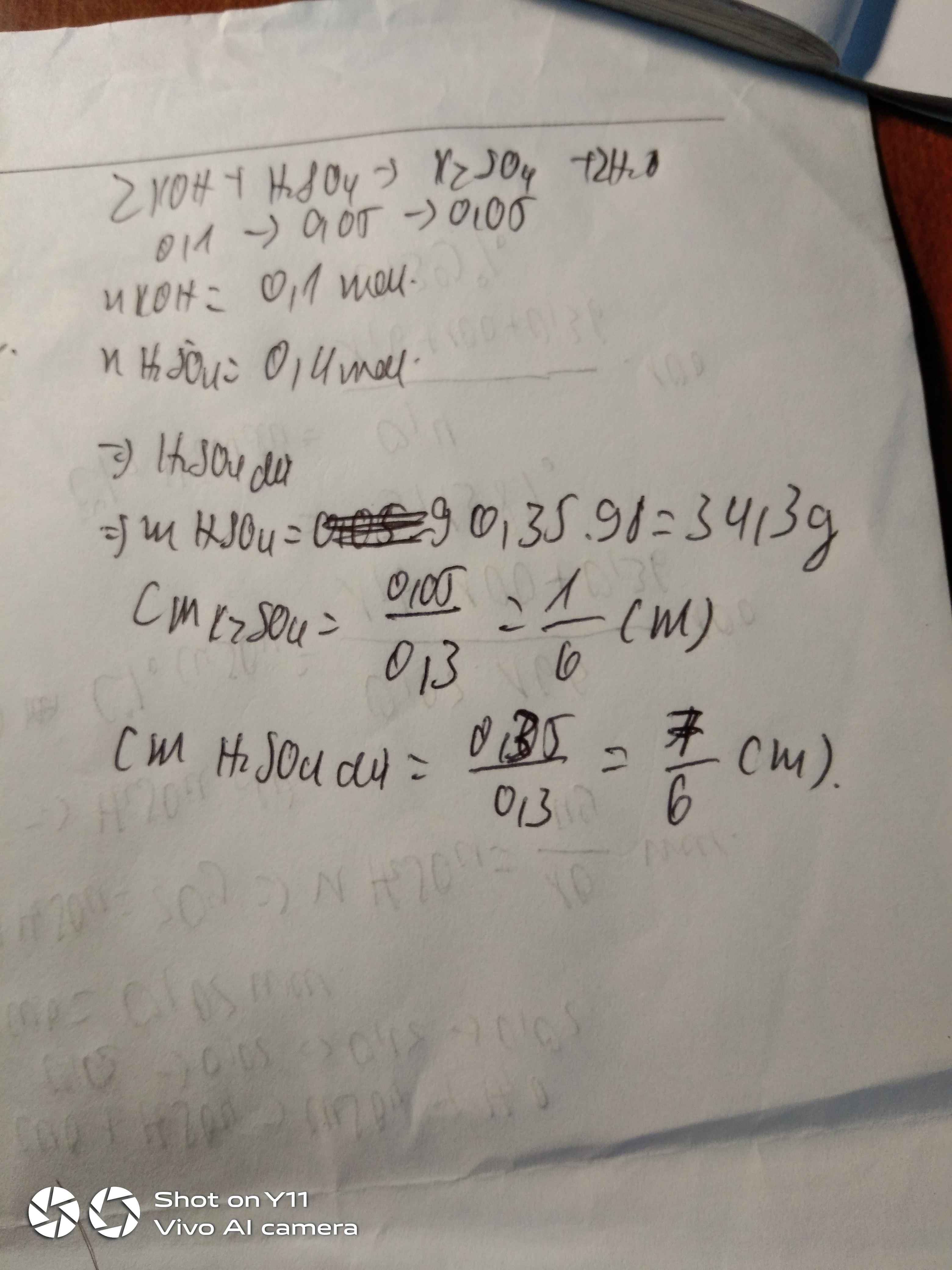
Đổi 200ml = 0.2 (l), 400 ml = 0.4 (l)
\(n_{HCl}=0,2.1=0,2\left(mol\right)\)
\(n_{H2SO4}=0,2.1=0,2\left(mol\right)\)
\(\Rightarrow CM_{dd\left(H2SO4\right)}=\frac{0,2}{0,4}=0,5M\)
\(\Rightarrow CM_{dd\left(H2SO4\right)}=\frac{0,2}{0,4}=0,5M\)