Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Cu + O2 \(\Rightarrow t^o\)\(2CuO\)\(\)
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
2H2 + O2 \(2H_2O\)
- Tác dụng với một số phi kim khác:
4P + 5O2 \(\rightarrow t^o\)\(2P_2O_5\)
+ Tác dụng với một số hợp chất:
2C2H6 + 7O2 \(\rightarrow t^o4CO_2\)\(+6H_2O\)

REFER
Khí oxi là một đơn chất phi kim rất hoạt động, đặc biệt ở nhiệt độ cao, dễ dàng tham gia phản ứng hóa học với nhiều phi kim, nhiều kim loại và hợp chất. Trong các hợp chất hóa học, nguyên tố oxi có hóa trị II.
Cụ thể:
- Tác dụng với kim loại: O2 oxi hóa được hầu hết các kim loại trừ Ag, Au, Pt.
Ví dụ:
- Tác dụng với hiđro, phản ứng có thể gây nổ mạnh nếu tỉ lệ thể tích O2 : H2 = 1:2
Phương trình hóa học:
- Tác dụng với một số phi kim khác:
Ví dụ:
+ Tác dụng với một số hợp chất:
Ví dụ:

- Tác dụng với kim loại:
Nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
- Tác dụng với một số oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
\(K_2O+H_2O\rightarrow2KOH\)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
- Tác dụng với oxit axit như SO3, P2O5… tạo thành axit tương ứng H2SO4, H3PO4,…
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(P_2O_5+3H_2O\rightarrow2H_3PO_4\)

Tính chất hóa học :
- Tác dụng với kim loại tạo oxit bazo hoặc oxit lưỡng tính
$4Na + O_2 \xrightarrow{t^o} 2Na_2O$
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
- Tác dụng với phi kim tạo oxit trung tính, oxit axit,..
$S + O_2 \xrightarrow{t^o} SO_2$
$2C + O_2 \xrightarrow{t^o} 2CO$
- Tác dụng với một số hợp chất khác :
$2CO + O_2 \xrightarrow{t^o} 2CO_2$
$CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
$4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 8SO_2$

THAM KHẢO:
Tính chất vật lí của hidro.
Ở điều kiện thường hidro tồn tại ở dạng phân tử gồm hai nguyên tử hidro. Khí nhẹ hơn không khí 14,5 lần ( ), không màu, không mùi, ít tan trong nước, dễ cháy tạo thành hơi nước, có nhiệt độ sôi -252,87 °C và nhiệt độ nóng chảy -259,14 °C…
Tính chất vật lýTính chất của oxi là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
Tính chất hóa học:
Khí oxi (O2) là một chất khí không có màu sắc, không mùi vị, oxi ít tan trong nước và nặng hơn không khí. Nhiệt độ để oxi hóa lỏng là -183 độ và có màu xanh nhạt khi hóa lỏng.
Tính chất hóa học của hidro:
Hidro là phi kim, có hóa trị I và có thể phản ứng với hầu hết các nguyên tố hóa học khác nhau. Hidro bị kim loại (Fe, Ni, Pt, Pd) hấp thụ hóa học. Hidro là chất khử mạnh ở nhiệt độ cao.

vật lý : là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khi hóa lỏng sẽ có màu xanh nhạt.
hóa học
td với phi kim :
S+O2 -to-> SO2
td với Kim loại
2Zn + O2 -to -> 2ZnO
td với h/c
CH4 +2O2 -to-> CO2 +2H2O
ứng dụng : Oxi cần cho sự hộ hấ của con người và động vật , cần để đốt nhiên liệu trogn đời sống và sản suất
điều chế khí O2 bằng những chất dễ phân hủy và giàu oxii

tính chất vật lý
- Là chất lỏng không màu (tuy nhiên lớp nước dày có màu xanh da trời), không mùi, không vị
- Có thể hòa tan được nhiều chất rắn ( muối ăn, đường,…), chất lỏng ( còn, axit), chất khí (HCl,…)
tính chất hóa học :
- Tác dụng với kim loại: nước có thể tác dụng với một số kim loại ở nhiệt độ thường như Ca, Ba, K,…
\(pthh:Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
- Tác dụng với mốt sô oxit bazo như CaO, K2O,… tạo ra bazo tương ứng Ca(OH)2, KOH,…
- Dung dịch bazơ làm quỳ tím chuyển xanh
\(pthh:Na_2O+H_2O\rightarrow2NaOH\)
- Tác dụng với oxit axit như SO3, P2O5,… tạo thành axit tương ứng H2SO4, H3PO4,…
- Dung dịch axit làm quỳ tím chuyển đỏ
\(SO_2+H_2O\rightarrow H_2SO_3\)

Tác dụng với 1 số kim loại:
PTHH: 2K + 2 H2O → 2KOH + H2
Tác dụng với 1 số oxit bazơ:
PTHH: CaO + H2O → Ca(OH)2
Tác dụng với 1 số oxit axit:
PTHH: SO3 + H2O → H2SO4
2M + 2nH2O → 2M(OH)n + nH2↑
Ví dụ:
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Kim loại Mg tan rất chậm trong nước nóngMột số kim loại trung bình như Mg, Al, Zn, Fe…phản ứng được với hơi nước ở nhiệt độ cao tạo oxit kim loại và hiđroVí dụ:
Mg + H2Ohơi →MgO + H2
3Fe + 4H2Ohơi → Fe3O4+ 4H2
Fe + H2Ohơi → FeO + H2
2. Nước tác dụng với oxit bazoNước tác dụng với oxit bazơ tạo thành dung dịch bazo tương ứng.
H2O + Oxit bazơ→ Bazơ
Na2O + H2O → 2NaOH
Li2O +H2O→ 2LiOH
K2O +H2O→ 2KOH
CaO + H2O → Ca(OH)2
3. Nước tác dụng với oxit axitNước tác dụng với oxit axit tạo thành axit tương ứng.
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
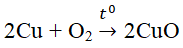
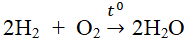
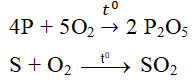
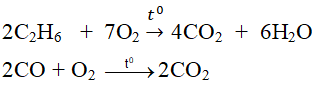

- Tác dụng được với nhiều phi kim (trừ Cl2, Br2, I2, F2,...)
\(Si+O_2\underrightarrow{t^o}SiO_2\\ 4P+5O_2\underrightarrow{t^o}2P_2O_5\)
- Tác dụng được với nhiều kim loại (trừ Ag, Pt, Au,...)
\(2Mn+O_2\underrightarrow{t^o}2MnO\\ 4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
- Tác dụng được với nhiều hợp chất:
\(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\uparrow\\ 2SO_2+O_2\xrightarrow[V_2O_5]{t^o}2SO_3\)