Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Nguyên liệu là các chất giàu oxi và dễ bị phân huỷ bởi nhiệt: KMnO4, KClO3, KNO3,...
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\\ 2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\\ 2KNO_3\underrightarrow{t^o}2KNO_2+O_2\)
pp thu khí oxi là:
- Đẩy nước (do oxi ít tan trong nước)
- Đẩy kk (do oxi nặng hơn kk nên ngửa bình)

1,
- Oxit là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxi
Ví dụ: CO2, SO2, CuO,...
- Sự tác dụng của oxi với một chất là sự oxi hóa
Ví dụ: Sắt tác dụng với oxi => sắt bị oxi hóa
2,
- Nguyên liệu để điều chế Oxi trong phòng thí nghiệm là: K

Tham khảo
+ Hóa chất để điều chế khí hiđro bao gồm: dung dịch axit HCl hoặc H2SO4 loãng; kim loại hoạt động trung bình như Zn, Fe, Al,…
PTHH
Zn + 2HCl → ZnCl2 + H2↑
+ Đẩy nước và đẩy không khí do tính không tan trong nước của hai khi và tính nặng hơn không khí của oxi và tính nhẹ hơn không khí của hidro

Cách thu khí ôxi : Bằng cách đẩy nước và đẩy không khí .
Cách thu khí hiđrô : Giống ôxi .
Cách tiến hành :
- Cho một lượng nhỏ (bằng hạt ngô) KMnO4 vào đáy ống nghiệm. Đặt một ít bồng gần miệng ống nghiệm.
- Dùng nút cao su có ống dẫn khí xuyên qua đậy kín ống nghiệm. Đặt ống nghiệm vào giá đỡ hoặc kẹp gỗ sao cho đáy ống nghiệm cao hơn miệng ống nghiệm chút ít.
- Nhánh dài của ống dẫn khí sâu gần sát đáy ống nghiệm (hoặc lọ thu).
- Dùng đèn cồn đun nóng cả ống nghiệm chứa KMnO4, sau đó tập trung đốt nóng phần có hóa chất. Kali pemanganat bị phân hủy tạo ra khí oxi. Nhận ra khí trong ống nghiệm (2) bằng que đóm còn hồng.
- Sau khi kiểm tra độ kín của các nút, đốt nóng ống nghiệm chứa KMnO4. Khí oxi sinh ra sẽ đẩy không khí hoặc đẩy nước và chứa trong ống nghiệm thu. Dùng nút cao su đậy kín ống nghiệm đã chứa đẩy bình oxi để dùng cho thí nghiệm sau.
1) Đẩy nước và đẩy không khí do tính không tan trong nước của hai khi và tính nặng hơn không khí của oxi và tính nhẹ hơn không khí của hidro
2)
- Điều chế H2 : Cho viên kẽm vào dung dịch HCl lấy dư
$Zn + 2HCl \to ZnCl_2 + H_2$
- Điều chế O2 :Nung KMnO4 trên ngọn lửa đèn cồn
$2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2$

- Tính chất hoá học:
+ Phản ứng với O2 ---> nước: \(2H_2+O_2\underrightarrow{t^o}2H_2O\)
+ Phản ứng với phi kim ---> hợp chất khí (axit không có oxi):
\(H_2+Cl_2\underrightarrow{\text{ánh sáng}}2HCl\)
\(H_2+S\underrightarrow{t^o}H_2S\)
+ Phản ứng với oxit kim loại (đứng sau Al) ---> kim loại + nước:
\(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ Ag_2O+H_2\underrightarrow{t^o}2Ag+H_2O\)
- Điều chế:
+ Nguyên liệu: Mg, Al, Pb, Zn, Fe, HCl, H2SO4 (loãng),...
+ Phương pháp: cho kim loại + axit ---> muối + H2
\(Mg+2HCl\rightarrow MgCl_2+H_2\\ 2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
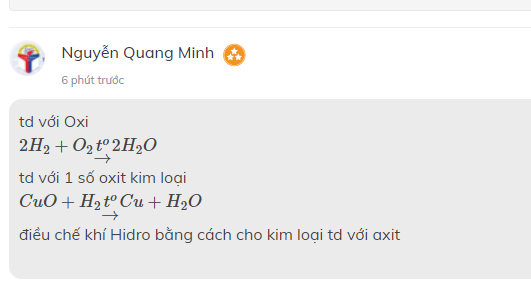
td với Oxi
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
td với 1 số oxit kim loại
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
điều chế khí Hidro bằng cách cho kim loại td với axit

a) bạn tự học SGK
b) Nguyên liệu điều chế O2: KMnO4, KClO3, KNO3 (độc), H2O,...
2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
2KClO3 -> (t°, MnO2) 2KCl + 3O2
2KNO3 -> (t°) 2KNO2 + O2
2H2O -> (đp) 2H2 + O2
Nguyên liệu điều chế H2: Pb, Zn, Fe, Al, HCl, H2SO4 loãng,...
Fe + 2HCl -> FeCl2 + H2
2Al + 3H2SO4 ->
Al2(SO4)3 + 3H2
2H2O -> (đp) 2H2 + O2

- Phương pháp điều chế: cho các kim loại (Al, Mg, Fe, Zn,...) tác dụng với dd axit (HCl, H2SO4 loãng,...)
- Cách thu: ngửa bình
- Khác với cách thu oxi: Thu oxi thì phải úp bình
Nguyên liệu: kim loại Al, Zn, Mg, Pb,... và ddaxit HCl, H2SO4 loãng
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Mg+H_2SO_4\rightarrow MgSO_4+H_2\\ Pb+H_2SO_4\rightarrow PbSO_4+H_2\)