Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a,\(3Fe+2O_2\underrightarrow{^{to}}Fe_3O_4\)
\(n_{Fe}=\frac{16,8}{56}=0,3\left(mol\right)\)
\(\Rightarrow n_{O2}=0,2\left(mol\right);n_{Fe3O4}=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe3O4}=0,1.232=23,2\left(g\right)\)
b,
\(V_{O2}=0,2.22,4=4,48\left(l\right)\)
\(\%O_2=\frac{1}{5}\Rightarrow V_{kk}=4,48.5=22,4\left(l\right)\)
c,
\(2KMnO_4\underrightarrow{^{to}}K_2MnO_4+MnO_2+O_2\)
\(n_{KMnO4}=0,4\left(mol\right)\)
\(\Rightarrow m_{KMnO4}=158.0,4=63,2\left(g\right)\)

Bài 1: Trong các oxit sau đây: SO3, CuO, Na2O, SO2, CO2, N2O3,CaO, Fe2O3, MgO, P2O5. Oxit naog là oxit axit, oxit bazơ? Gọi tên.
| oxit axi | gọi tên | oxit bazo | gọi tên |
| SO3 | Lưu huỳnh tri oxit | CuO | Đồng(II) oxit |
| SO2 | Lưu huỳnh đi oxit | Na2O | Natri oxit |
| CO2 | cacbon đi oxit | CaÒ | canxi oxit |
| N2O3 | đi Nito tri oxit | Fe2O3 | sắt(III) oxit |
| P2O5 | đi photpho pentaoxit | MgO | Magie oxit |
Bài 2:
S+O2--->SO2
2Cu+O2---->2CuO
4Na+O2--->2Na2O
2Ca+O2--->2CaO
3Fe+2O2---->Fe3O4
2Mg+O2--->2MgO
C+O2--->CO2
Bài 3
4P+5O2---->2P2O5
n P=6,2/31=0,2(mol)
n O2=6,72/22,4=0,3(mol)
0,2/4<0,3/5--->O2 dư.Tính theo chất hết
Theo pthh
n P2O5=1/2n P=0,1(mol)
m P2O5=0,1.142=14,2(g)
Bài 4
Fe2O3+3H2--->2Fe+3H2O
n Fe2O3=12/160=0,075(mol)
+n H2=3n Fe2O3=0,225(mol)
V H2=0,225.22,4=5,04(l)
+n Fe=2n Fe2O3=0,15(mol)
m Fe=0,15.56=8,4(g)
Bài 5.
a) Zn+H2SO4--->ZnSO4+H2
n Zn=19,5/65=0,3(mol)
Theo pthh
n ZnSO4=n Zn=0,3(mol)
m ZnSO4=0,3.161=48,3(g)
b) n H2=n Zn=0,3(mol)
V H2=0,3..22,4=6,72(l)
c)H2+CuO---->Cu+H2O
n CuO=16/80=0,2(mol)
--->H2 dư
n H2=n CuO=0,2(mol)
n H2 dư=0,3-0,2=0,1(mol)
m H2 dư=0,1.2=0,2(g)
Bài 6:
2KClO3---.2KCl+3O2
n O2=5,6/22,4=0,25(mol)
Theo pthh
n KClO3=2/3n O2=0,1667(mol)
m KClO3=0,1667/122,5=20,42(g)
Bị hao hụt 10%
--> m KClO3=20,42-(2042.10%)=18,378(g)
Bài 1 :
Oxit bazo: CuO,Na2O,CaO,Fe2O3,MgO
CuO: Đồng II oxit
Na2O: Natri oxit
CaO: Canxi oxit
Fe2O3: Sắt III oxit
MgO: Magie oxit
Oxit axit: SO3,SO2,CO2,N2O3,P2O5
SO3: Lưu huỳnh trioxit
SO2: Lưu huỳnh dioxit
CO2: Cacbon dioxit
N2O3: Đinito trioxit
P2O5: Điphotpho penta oxit
Bài 2 :
\(S+O_2\rightarrow SO_2\)
\(2Cu+O_2\rightarrow2CuO\)
\(4Na+O_2\rightarrow2Na_2O\)
\(2Ca+O_2\rightarrow2CaO\)
\(C+O_2\rightarrow CO_2\)
\(3Fe+2O_2\rightarrow Fe_3O_4\)
\(2Mg+O_2\rightarrow2MgO\)
Bài 3:
\(4P+5O_2\rightarrow2P_2O_5\)
Ta có: \(n_P=\frac{6,2}{31}=0,2\left(mol\right);n_{O2}=\frac{6,72}{22,4}=0,3\left(mol\right)\)
Vì \(n_{O2}>\frac{5}{4n_P}\) nên O2 dư
\(\rightarrow n_{P2O5}=\frac{1}{2}n_P=0,1\left(mol\right)\)
\(\rightarrow m_{P2O5}=0,1.\left(31.2+16.5\right)=14,2\left(g\right)\)
Bài 4:
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
Ta có: \(n_{Fe2O3}=\frac{12}{56.2+16.3}=0,075\left(mol\right)\)
\(\rightarrow n_{H2}=3n_{Fe2O3}=0,225\left(mol\right)\)
\(\rightarrow V_{H2}=0,225.22,4=5,04\left(l\right)\)
\(n_{Fe}=2n_{Fe2O3}=0,15\left(mol\right)\rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
Bài 5:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Ta có: \(n_{Zn}=\frac{19,5}{65}=0,3\left(mol\right)\)
Theo phản ứng:
\(n_{Zn}=n_{ZnSO4}=n_{H2}=0,3\left(mol\right)\)
\(\rightarrow m_{H2SO4}=0,3.\left(65+96\right)=48,3\left(g\right)\)
\(\rightarrow V_{H2}=0,3.22,4=6,72\left(l\right)\)
\(H_2+CuO\rightarrow Cu+H_2O\)
Ta có:
\(n_{CuO}=\frac{16}{64+16}=0,2\left(mol\right)\)
Vì nH2 > nCuO nên H2 dư
\(\rightarrow n_{H2_{du}}=0,3-0,2=0,1\left(mol\right)\rightarrow m_{H2}=0,1.2=0,2\left(g\right)\)
Bài 6 :
Oxi hao hụt 10% \(\rightarrow H=90\%\)
\(n_{O2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
\(2KClO_3\rightarrow2KCl+3O_2\)
1/6_______________0,25
Mà H = 90%
\(\rightarrow m_{KClO3_{can}}=\frac{\frac{1}{6}.122,5}{90\%}=22,69\left(g\right)\)
Bài 7:
Khí là SO2; bột là P2O5
\(S+O_2\rightarrow SO_2\)
\(4P+5O_2\rightarrow2P_2O_5\)
Chất bột là P2O5
\(\rightarrow m_{P2O5}=28,4\left(g\right)\rightarrow n_{P2O5}=\frac{28,4}{31,2+16.5}=0,2\left(mol\right)\)
\(\rightarrow n_P=2n_{P2O5}=0,4\left(mol\right)\)
Vì \(n_{P2O5}=2n_{SO3}\rightarrow n_{SO2}=0,1\left(mol\right)\rightarrow n_S=0,1\left(mol\right)\)
\(\rightarrow m_P+m_S+0,4.31+0,1.32=15,6\left(g\right)\rightarrow m=\frac{15,6}{80\%}=19,5\left(g\right)\)
\(\rightarrow\%m_P=\frac{0,4.31}{19,5}=63,6\%;\%m_S=\frac{0,1.32}{19,5}=16,4\%\)
c) \(n_{O2_{pu}}=2n_{O2}+\frac{5}{4}n_P=0,1.2+\frac{5}{4}.0,4=0,7\left(mol\right)\)
Vậy số phân tử O2 \(=0,7.6.10^{23}=4,3.10^{23}\) (phân tử)
Bài 8:
\(3Fe+2O_2\rightarrow Fe_3O_4\)
Ta có: \(n_{Fe2O3}=\frac{2,32}{56.3+16.4}=0,01\left(mol\right)\)
\(\rightarrow n_{Fe}=3n_{Fe3O4}=0,03\left(mol\right)\rightarrow m_{Fe}=0,03.56=1,68\left(g\right)\)
\(\rightarrow n_{O2}=2n_{Fe3O4}=0,02\left(mol\right)\rightarrow m_{O2}=0,02.32=0,64\left(g\right)\)
\(2KMnO_4\rightarrow K_2MnO_4+MnO_4+O_2\)
\(\rightarrow n_{KMnO4}=2n_{O2}=0,04\left(mol\right)\rightarrow m_{KMnO4}=0,04.\left(39+55+16,4\right)=6,32\left(g\right)\)
Bài 9:
\(4Al+3O_2\rightarrow2Al_2O_3\)
Ta có: \(n_{Al}=\frac{5,4}{27}=0,2\left(mol\right)\)
\(\rightarrow n_{O2}=\frac{3}{4}n_{Al}=0,15\left(mol\right)\rightarrow V_{O2}=0,15.22,4=3,36\left(l\right)\)
\(2KMnO_4\rightarrow KMnO_4+MnO_2+O_2\)
\(\rightarrow n_{KMnO4}=2n_{O2}=0,3\left(mol\right)\)
\(\rightarrow m_{KMnO4}=0,3.\left(39+55+16.4\right)=47,4\left(g\right)\)
Bài 10:
\(m_C=1000.95\%=950\left(g\right)\)
\(C+O_2\rightarrow CO_2\)
12g_______ 44g
950g_______g
\(\Rightarrow x=\frac{950.44}{12}=3483\left(g\right)\)
=>V=3483/44x22,4=1773 l=1,773 m3

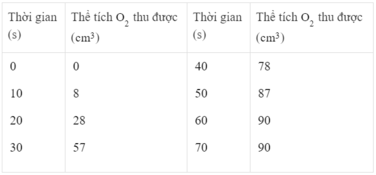
Thể tích khí oxi thu được ở các thời điểm :
25 giây : Khoảng 40 cm 3
45 giây : Khoảng 83 cm 3

Đáp án C
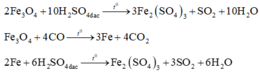
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
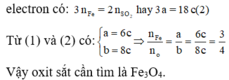

Đáp án C
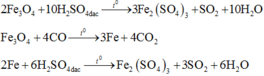
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:



H2 + 1/2O2 = H20
nH2=4,48:22,4=0,2(mol)
Theo PTPU:nO2=1/2.nH2=1/2.0,2=0,1(mol)
=>VO2=0,1.22,4=2,24(l)
b)Theo PTPU:nH2O=nH2=0,2(mol)
=>mH2O=0,2.18=3,6(g)
c) H2 + FeO = Fe + H2O
Theo PTPU:nFe=nH2=0,2(mol)
=>mFe=0,2.56=11,2(g)
Ta có: \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 -to-> 2H2O (1)
Theo PTHH và đề bài, ta có:
\(n_{O_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ n_{H_2O}=n_{H_2}=0,2\left(mol\right)\)
a) Thể tích khí O2 cần dùng (đktc):
\(V_{O_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\)
b) Khối lượng H2O thu được:
\(m_{H_2O}=0,2.18=3,6\left(g\right)\)
c) PTHH: H2 + FeO -to-> Fe + H2O (2)
Từ các PTHH và đb, ta có:
\(n_{H_2\left(2\right)}=n_{H_2\left(1\right)}=0,2\left(mol\right)\\ =>n_{Fe}=n_{H_2\left(2\right)}=0,2\left(mol\right)\)
Khối lượng Fe thu được:
\(m_{Fe}=0,2.56=11,2\left(g\right)\)

Chỉ có HCl tác dụng với MnO2 ở nhiệt độ thường mới điều chế được khí Clo.
Các cặp chất khác đều có nhiệt độ cao.

Bài 1
a)\(2Zn+O2-->2ZnO\)
b)\(n_{ZnO}=\frac{48,6}{81}=0,6\left(mol\right)\)
\(n_{O2}=\frac{1}{2}n_{Zn}=0,3\left(mol\right)\)
\(V_{O2}=0,3.22,4=6,72\left(l\right)\)
c)Cách 1
\(n_{Zn}=n_{ZnO}=0,6\left(mol\right)\)
\(m_{Zn}=0,6.65=39\left(g\right)\)
Cách 2
\(m_{O2}=0,3.32=9,6\left(g\right)\)
\(m_{Zn}=m_{ZnO}-m_{O2}=48,6-9,6=39\left(g\right)\)
Bài 2
a)\(m_{Mg}=9,6.12,5\%=1,2\left(g\right)\)
\(m_{Fe}=9,6-1,2=8,4\left(g\right)\)
b)\(2Mg+O2-->2MgO\)
\(3Fe+2O2-->Fe3O4\)
\(n_{Mg}=\frac{1,2}{24}=0,05\left(mol\right)\)
\(n_{Fe}=\frac{8,4}{56}=0,15\left(mol\right)\)
\(n_{MgO}=n_{Mg}=0,05\left(mol\right)\)
\(m_{gO}=0,05.40=2\left(g\right)\)
\(n_{Fe3O4}=\frac{1}{3}n_{Fe}=0,05\left(mol\right)\)
\(m_{Fe3O4}=0,05.232=11,6\left(g\right)\)

Trong phòng thí nghiệm, khí Clo được điều chế bằng cách oxi hóa HCl, cho HCl tác dụng với cấc chất oxi hóa mạnh như KClO3, KMnO4, MnO2,…
\(n_{Fe_3O_4}=\frac{3,48}{232}=0,015mol\)
\(PTHH:3Fe+2O_2\rightarrow^{t^o}Fe_3O_4\)
\(m_{Fe}=0,045.56=2,52g\)
\(V_{O_2}=0,03.22,4=0,672l\)