
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tham Khảo
Em coi có cái nào chưa hiểu thì hỏi nhé
ỨNG DỤNG CỦA KHÍ NITƠ TRONG ĐỜI SỐNG
- Nitơ dạng khí hóa lỏng được sản xuất nhanh chóng bằng cách cho nitơ lỏng ấm lên và bay hơi.
- Nó có nhiều ứng dụng, bao gồm cả việc phục vụ như là sự thay thế trơ hơn cho không khí khi mà sự ôxi hóa là không mong muốn;
- Bơm lốp ô tô và máy bay do tính trơ và sự thiếu các tính chất ẩm, ôxi hóa của nó, ngược lại với không khí.
- Khí Nitơ có tác dụng làm chậm sự ôi thiu và các dạng tổn thất khác gây ra bởi sự ôxi hóa nhằm để bảo quản tính tươi của thực phẩm đóng gói hay dạng rời, bảo quản thực phẩm không bị oxy hoá bằng khí Nitơ hóa lỏng.
- Khí Nitơ hóa lỏng dùng trong chạy máy phân tích, phân tích mẫu.
- Khí Nitơ hóa lỏng dùng để xả làm sạch, thử xì đường ống, hàn đường ống, luyện kim, tinh chế kim loại, sản xuất các linh kiện điện tử như tranzito, điôt, và mạch tích hợp, sản xuất thép không gỉ...
- Khí Nitơ hóa lỏng có thể thay thế cho khí CO2 để tạo áp lực cho các thùng chứa một số loại bia.
- Khí Nitơ lỏng được sản xuất theo quy mô công nghiệp với một lượng lớn bằng cách chưng cất phân đoạn không khí hóa lỏng và nó thường được nói đến theo công thức giả LN2.
- Khí Nitơ còn có khả năng trong việc duy trì nhiệt độ một cách siêu phàm, làm cho nó cực kỳ hữu ích trong nhiều ứng dụng khác nhau, đóng vai trò của một chất khí hóa lỏng làm lạnh chu trình mở, bao gồm: làm lạnh để vận chuyển thực phẩm, bảo quản các bộ phận thân thể cũng như các tế bào tinh trùng và trứng, các mẫu và chế phẩm sinh học. Trong da liễu học khí Nitơ hóa lỏng để loại bỏ các tổn thương da ác tính xấu xí hay tiềm năng gây ung thư, ví dụ các mụn cóc, các vết chai sần trên da v.v.
- Khí Nitơ hóa lỏng có thể sử dụng như là nguồn làm mát để tăng tốc CPU, GPU, hay các dạng phần cứng khác.

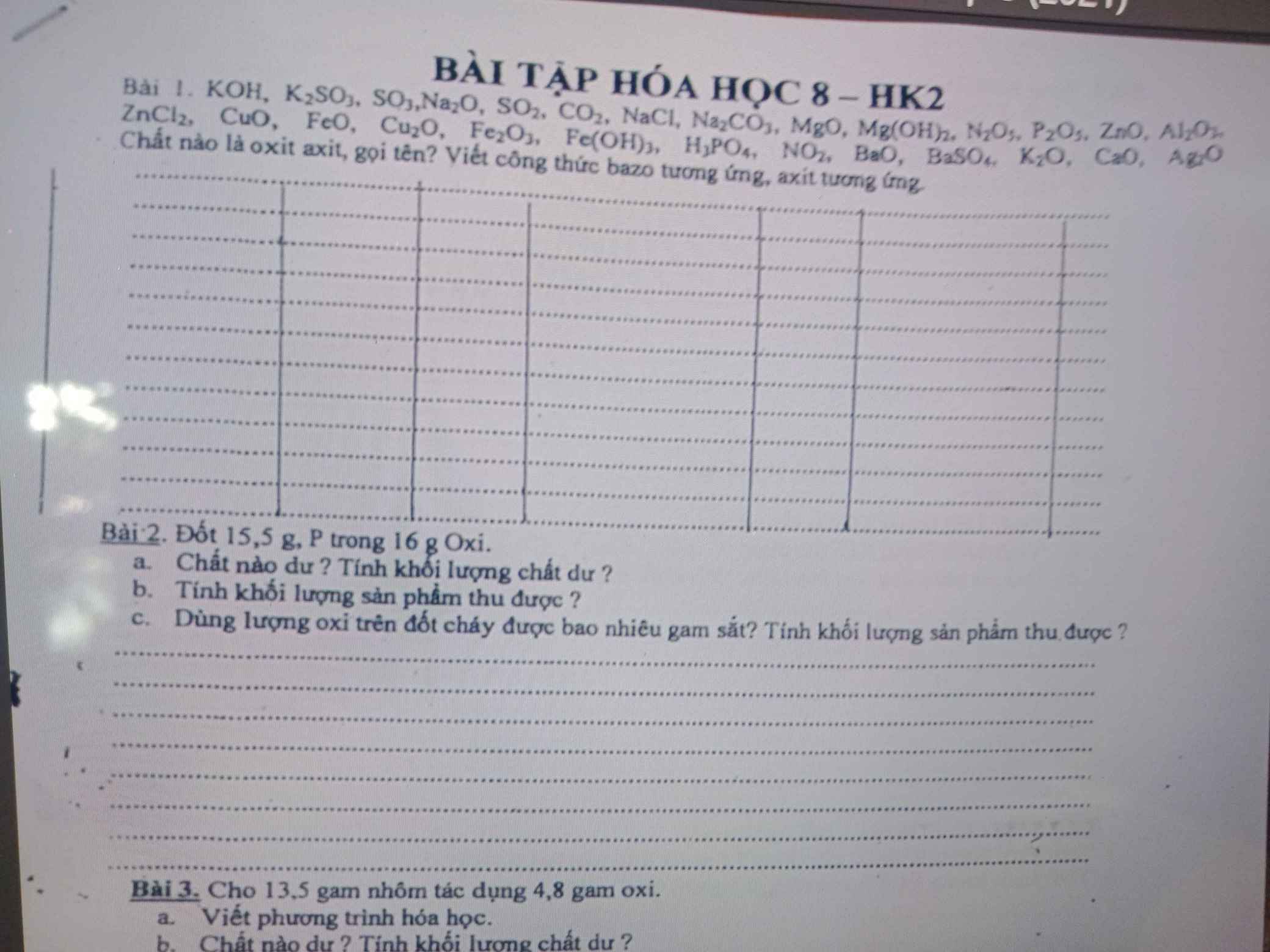
Bài 1: Oxit axit:
\(SO_3:\) Sulfur trioxide, axit tương ứng: \(H_2SO_4\)
\(SO_2\): Sulfur dioxide, axit tương ứng: \(H_2SO_3\)
\(CO_2:\) Carbon dioxide, axit tương ứng: \(H_2CO_3\)
\(N_2O_5:\) Dinitrogen pentoxide, axit tương ứng: \(HNO_3\)
\(P_2O_5:\) Phosphorus pentoxide, axit tương ứng: \(H_3PO_4\)
\(NO_2:\) Nitrogen dioxide, axit tương ứng: \(HNO_3\)
tất cả đều là oxit axit trừ:
\(NaCl;Na_2CO_3;MgO;Mg\left(OH\right)_2;Na_2O_3\\ ;ZnO;ZnCl_2;Fe\left(OH\right)_3;H_3PO_4;BaSO_4;Ag_2O;K_2SO_3\)
gọi tên của các oxit axit:
KOH:Kali hydroxide
SO3:Lưu huỳnh trioxide
Na2O: Natri oxide
mấy tên còn lại bn cứ theo cách gọi mà làm nhe , gọi tên nó theo 2345 j ấy rồi thêm oxide vô nha.

E làm sai nhiều nên a làm lại nhé
a)
Axit : H2SO4,HCl
Bazo : NaOH,Fe(OH)2
Oxit : MgO,CaO
Muối : Những chất còn lại
b)
Axit : H3PO4,HBr
Bazo : KOH,Zn(OH)2
Oxit : CaO,FeO
Muối : Những chất còn lại
c)
Axit : H2SO4,HCl
Bazo : Zn(OH)2 , Fe(OH)3
Oxit : CuO,CO2
Muối: Những chất còn lại

Ngâm một lá sắt nặng 56g trg 300ml dd CuSO4 1M, sau pản ứng lấy lá kim loại ra rửa nhẹ,lm khô cân lại thấy nặng 57,6g. a.Tính khối lượng sắt đã pản ứng. b. Đem dd sau pản ứng td vs dd NaOH dư.Lọc lấy kết tủa thu đc sau pản ứng đem nung trg ko khí đến khối lượng ko đổi thu đc bao nhiêu g chất rắn?
(giải giúp em bài này nx vs ạ)
C12:
\(nK=\dfrac{19,5}{39}=0,5\left(mol\right)\)
\(2K+2H_2O\rightarrow2KOH+H_2\)
0,5 0,5 0,5 0,25 (mol)
mKOH = 0,5.56 = 28 (g)
m\(H_2=0,25.2=0,5\left(g\right)\)
mdd = mK + mddH2O - mH2
= 19,5 + 261 - 0,5 = 280 (g)
\(C\%_{dd}=\dfrac{28.100}{280}=10\%\)
=> Chọn D
II. Tự luận
C1 :
\(4P+5O_2\underrightarrow{t^o}2P_2O_5\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
C2 :
\(N_2O_5+H_2O\rightarrow2HNO_3\)
=> Pứ hóa hợp
\(Fe_2O_3+3CO\underrightarrow{t^o}2Fe+3CO_2\)
=> Pứ thế
C3:
Trích mẫu thử ở mỗi dung dịch , đánh số thứ tự , ta nhúng quỳ :
+ Quỳ chuyển đỏ : HCl
+ Quỳ chuyển xanh : NaOH
+ Quỳ không chuyển màu : NaCl
C4:
\(nCuO=\dfrac{2,4}{80}=0,03\left(mol\right)\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,03-->0,03--->0,03-->0,03
\(VH_2=0,03.22,4=0,672\left(l\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,02 0,03 (mol)
\(mAl=0,02.27=0,54\left(g\right)\)






Câu 1:
(1) \(4P+5O_2\xrightarrow[]{t^\circ}2P_2O_5\)
(2) \(4FeS_2+11O_2\xrightarrow[]{t^\circ}2Fe_2O_3+8SO_2\uparrow\)
(3) \(Fe\left(OH\right)_3+3HCl\xrightarrow[]{}FeCl_3+3H_2O\)
(4) \(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
(5) \(4Fe\left(OH\right)_2+O_2+2H_2O\xrightarrow[]{t^\circ}4Fe\left(OH\right)_3\)