Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Phương trình phản ứng :
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
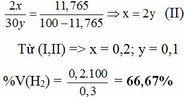
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.

n Br2=\(\dfrac{32}{160}\)=0,2 mol
C2H2+2Br2->C2H2Br4
0,1------0,2 mol
=>%VC2H2=\(\dfrac{0,1.22,4}{5,6}\).100=40%
=>%VCH4=100-40=60%
=>n CH4=\(\dfrac{5,6-0,1.22,4}{22,4}\)=0,15 mol
CH4+2O2-to>CO2+2H2O
0,15----0,3
C2H2+\(\dfrac{5}{2}\)O2-to>2CO2+H2O
0,1-----0,25 mol
=>VO2=(0,3+0,25).22,4=12,32l

Ta có: \(n_{Br_2}=\dfrac{6}{160}=0,0375\left(mol\right)\)
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Theo PT: \(n_{C_2H_4}=n_{Br_2}=0,0375\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,0375.22,4}{6,72}.100\%=12,5\%\\\%V_{CH_4}=87,5\%\end{matrix}\right.\)

C2H2+2Br2->C2H2Br4
x-----------2x
C2H4+Br2->C2H4Br2
y-----------2y
n Br2=0,8 mol
\(\left\{{}\begin{matrix}x+y=0,6\\2x+y=0,8\end{matrix}\right.\)
=>x=0,2 ,y=0,4 mol
=>%VC2H2=\(\dfrac{0,2.22,4}{13,44}100\)=33,33%
=>%C2H4=66,67%
C2H4+3O2-tO>2CO2+2H2O
C2H2+5\2O2-to>2CO2+H2O
=>Vkk=1,7.22,4.5=190,4l

a, Ta có: \(n_{CH_4}+n_{C_2H_4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(1\right)\)
\(16n_{CH_4}+28n_{C_2H_4}=3\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,1\left(mol\right)\\n_{C_2H_4}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%\approx53,33\%\\\%m_{C_2H_4}\approx46,67\%\end{matrix}\right.\)
- Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là %V.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%\approx66,67\%\\\%V_{C_2H_4}\approx33,33\%\end{matrix}\right.\)
b, PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Có: m tăng = mC2H4 = 0,05.28 = 1,4 (g)
a) \(n_{hh}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_4}=b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,15\\16a+28b=3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,05\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,1}{0,15}.100\%=66,67\%\\\%V_{C_2H_4}=100\%-66,67\%=33,33\%\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,1.16}{3}.100\%=53,33\%\\\%m_{C_2H_4}=100\%-53,33\%=46,67\%\end{matrix}\right.\)
b) \(m=m_{C_2H_4}=0,05.28=1,4\left(g\right)\)

\(m_{tăng}=m_{C_2H_2}=0,78\left(g\right)\\PTHH:C_2H_2+2Br_2\rightarrow C_2H_2Br_4\\ n_{C_2H_2}=\dfrac{0,78}{26}=0,03\left(mol\right)\\ n_{hh.khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\\Rightarrow n_{CH_4}=0,1-0,03=0,07\left(mol\right)\\ n.tỉ.lệ.thuận.với.V\\ \%V_{CH_4}=\dfrac{0,07}{0,1}.100\%=70\%;\%V_{C_2H_2}=100\%-70\%=30\%\)

\(m_{bìnhtăng}=m_{anken}=m_{etilen}=1,4g\)
\(\Rightarrow n_{C_2H_4}=\dfrac{1,4}{28}=0,05mol\)
\(n_{hh}=\dfrac{4,48}{22,4}=0,2mol\)
\(\Rightarrow n_{metan}=n_{hh}-n_{eilen}=0,2-0,05=0,15mol\)
\(\%V_{metan}=\dfrac{0,15}{0,2}\cdot100\%=75\%\)
\(\%V_{etilen}=100\%-75\%=25\%\)
Sửa đề : 11.2 (l)
\(n_{hh}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(m_{Br_2}=320\cdot\dfrac{15}{100}=48\left(g\right)\)
\(n_{Br_2}=\dfrac{48}{160}=0.3\left(mol\right)\)
\(\)\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
\(0.15..........0.3\)
\(V_{CH_4}=0.5-0.15=0.35\left(mol\right)\)
\(\%C_2H_2=\dfrac{0.15}{0.5}\cdot100\%=30\%\)
\(\%CH_4=70\%\)