
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(1\\ a,KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\left(\text{phản ứng phân hủy }\right)\\ 3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\left(\text{phản ứng hóa hợp }\right)\\ Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\left(\text{phản ứng thế}\right)\\ 2H_2+O_2\underrightarrow{t^o}2H_2O\left(\text{phản ứng hóa hợp }\right)\\ b,4P+5O_2\underrightarrow{t^o}2P_2O_5\left(\text{phản ứng hóa hợp }\right)\\ P_2O_5+3H_2O\rightarrow2H_3PO_4\left(\text{phản ứng hóa hợp }\right)\)
\(c,Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\left(\text{phản ứng thế }\right)\\
4Na+O_2\underrightarrow{t^o}2Na_2O\left(\text{phản ứng hóa hợp }\right)\\
Na_2O+H_2O\rightarrow2NaOH\left(\text{phản ứng hóa hợp }\right)\)


Trả lời :
Câu 10. Hợp chất của một nguyên tố R với hiđro có công thức hoá học là RH4 chứa 25% hiđro về khối lượng. Tên của R là
A. nhôm B. photpho C. silic D. cacbon
HD : Xét về hoá trị với hydro ta loại được 2 trường hợp nhôm và photpho (hợp chất tương ứng của chúng là : \(AlH_3\) (Aluman) và \(PH_3\) (Photphin))
Còn lại 2 trường hợp ta ghép và tính phân tử khối rồi tính thành phần % nguyên tố. Ta thấy \(CH_4\) là hợp lệ với đề bài.
Vậy nguyên tố cần chọn là cacbon
~HT~

Cau 1
a, Cac pthh
2K + 2H2O \(\rightarrow\) 2KOH + H2
BaO + H2O \(\rightarrow\) Ba(OH)2
SO3 + H2O \(\rightarrow\) H2SO4
Zn + H2SO4 \(\rightarrow\) ZnSO4 + H2
b, Phan loai va goi ten
Muoi : ZnSO4 \(\rightarrow\) Kem sunfat
Bazo : Ba(OH)2 \(\rightarrow\) Bari hidroxit
KOH \(\rightarrow\) Kali hidroxit
Axit : H2SO4 \(\rightarrow\) axit sunfuric
Cau 3
Ta co pthh
Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
Theo de bai ta co
nFe=\(\dfrac{11,2}{56}=0,2mol\)
a, Theo pthh
nFeSO4=nFe=0,2 mol
\(\Rightarrow\) mFeSO4=0,2.152=30,4 g
\(\Rightarrow\) mddFeSO4 =\(\dfrac{mct.100\%}{C\%}=\dfrac{30,4.100\%}{14,7\%}\approx206,80g\)
b, Theo pthh
nH2SO4=nFe=0,2 mol
\(\Rightarrow\) mH2SO4=0,2.98=19,6 g
c, Theo pthh
nH2=nFe=0,2 mol
\(\Rightarrow\)mdd H2SO4=mFe + mH2SO4 - mH2=11,2 + 19,6-(0,2.2)=30,4g
\(\Rightarrow\) Nong do % dung dich H2SO4 la
C%=\(\dfrac{mct}{mdd}.100\%=\dfrac{19,6}{30,4}.100\%\approx64,47\%\)
Câu 3 : Fe + H2SO4 \(\rightarrow\) FeSO4 + H2
a) nFe = 11,2/56 = 0,2(mol)
Theo PT => nFeSO4 = nFe = 0,2(mol)
=> mFeSO4 = 0,2 . 152 = 30,4(g)
=> mdd FeSO4 = \(\dfrac{m_{ct}.100\%}{C\%}=\dfrac{30,4.100\%}{14,7\%}=206,8\left(g\right)\)
b) Theo PT => nH2 = nFe = 0,2(mol)
=> mH2 = 0,2 .2 =0,4(mol)
Theo ĐLBTKL : mdd sau pứ = mFe + mdd H2SO4 - mH2
=> 206,8 = 11,2 + m - 0,4
=> m =196(g)
c)Theo PT => nH2SO4 = nFe = 0,2(mol)
=> mH2SO4 = 0,2 . 98 = 19,6(g)
=> C%ddH2SO4 = \(\dfrac{m_{Ct}}{m_{dd}}.100\%=\dfrac{19,6}{196}.100\%=10\%\)

Câu 1:
a, \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
b, \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, \(n_{HCl}=3n_{Al}=0,6\left(mol\right)\)
\(\Rightarrow C\%_{HCl}=\dfrac{0,6.36,5}{200}.100\%=10,95\%\)
d, \(n_{AlCl_3}=n_{Al}=0,2\left(mol\right)\Rightarrow m_{AlCl_3}=0,2.133,5=26,7\left(g\right)\)

\(a,2KMnO_4\rightarrow\left(t^o\right)K_2MnO_2+MnO_2+O_2\\ b,n_{KMnO_4}=\dfrac{31,6}{158}=0,2\left(mol\right)\\ \Rightarrow n_{O_2}=\dfrac{0,2}{2}=0,1\left(mol\right)\\ \Rightarrow V_{O_2\left(đktc\right)}=0,1.22,4=2,24\left(l\right)\\ c,n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ 3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\\ Vì:\dfrac{0,2}{3}< \dfrac{0,1}{2}\Rightarrow Fedư\\ \Rightarrow n_{Fe_3O_4}=n_{O_2}:2=0,1 :2=0,05\left(mol\right)\\ \Rightarrow m_{Fe_3O_4}=232.0,05=11,6\left(g\right)\)

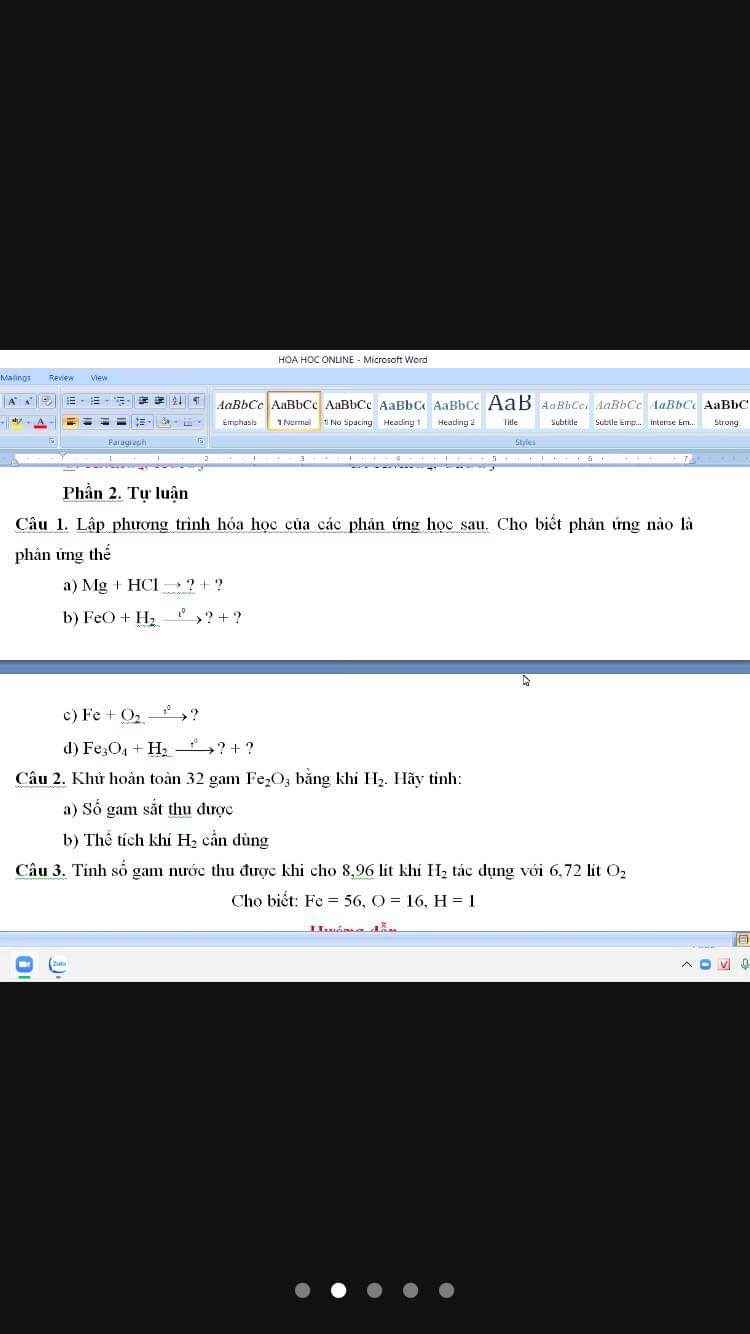








Câu 1.
c)\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
d)\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)\(\Rightarrow\) phản ứng thế