Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Đặt
![]()
Khối lượng muối khan giảm là do đã xảy ra phản ứng thay thế các nguyên tử halogen trong muối.
Ta có hệ:
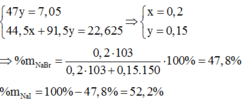

a.\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
b.\(n_{hhk}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
Ta thu được hh khí --> S hết, Fe dư
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_S=y\end{matrix}\right.\)
\(\rightarrow n_{FeS}=n_{Fe}=n_S\rightarrow n_{Fe\left(dư\right)}=x-y\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(x-y\) \(x-y\) ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có: \(\left(x-y\right)+y=0,2\)
\(\Leftrightarrow x=0,2\)
Ta có:\(56x+32y=14,4\)
\(\Leftrightarrow56.0,2+32y=14,4\)
\(\Leftrightarrow y=0,1\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{14,4}.100=77,77\%\\\%m_S=100\%-77,77\%=22,23\%\end{matrix}\right.\)

\(n_{KMnO_4}=\frac{15,8}{158}=0,1\left(mol\right)\)
PTHH : \(2KMnO_4+16HCl-->2KCl+2MnCl_2+5Cl_2+8H_2O\) (1)
\(Cl_2+H_2-as->2HCl\) (2)
Có : \(m_{ddHCl}=100\cdot1,05=105\left(g\right)\)
=> \(m_{HCl}=105-97,7=7,3\left(g\right)\)
=> \(n_{HCl}=\frac{7,3}{36,5}=0,2\left(mol\right)\)
BT Clo : \(n_{Cl_2}=\frac{1}{2}n_{HCl}=0,1\left(mol\right)\)
Mà theo lí thuyết : \(n_{Cl_2}=\frac{5}{2}n_{KMnO_4}=0,25\left(mol\right)\)
=> \(H\%=\frac{0,1}{0,25}\cdot100\%=40\%\)
Vì spu nổ thu được hh hai chất khí => \(\hept{\begin{cases}H_2\\HCl\end{cases}}\) (Vì H2 dư)
=> \(n_{hh}=\frac{13,44}{22,4}=0,6\left(mol\right)\)
=> \(n_{H_2\left(spu\right)}=n_{hh}-n_{HCl\left(spu\right)}=0,6-0,2=0,4\left(mol\right)\)
BT Hidro : \(\Sigma_{n_{H2\left(trong.binh\right)}}=n_{H_2\left(spu\right)}+\frac{1}{2}n_{HCl}=0,4+0,1=0,5\left(mol\right)\)
đọc thiếu đề câu a wtf
\(C_{M\left(HCl\right)}=\frac{0,2}{0,1}=2\left(M\right)\)

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

Chọn đáp án C
Gọi số mol của NaBr là x mol; NaI là y mol.
Cho B r 2 vào dung dịch A, chỉ NaI phản ứng.
NaI + 1 2 Br2 → NaBr + 1 2 I2
1 mol NaI → 1 mol NaBr khối lượng giảm 47g
→ n N a I = 7 , 05 47 = 0,15 mol = y
Khi sục khí Clo vào dung dịch A, cả NaBr và NaI phản ứng.
m m u ố i g i ả m = x.(80 – 35,5) + y (127-35,5) = 22,625 g
→ x = 0,2 mol
ð % m N a B r = 0 , 2 . 103 0 , 2 . 103 + 0 , 15 . 150 .100(%) = 47,80(%)

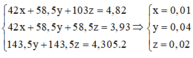
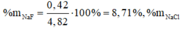
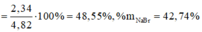


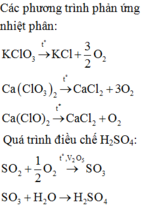
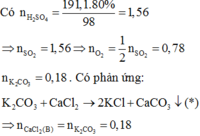


Câu 1:
\(2KCl\underrightarrow{^{đp}}2K+Cl_2\)
\(KCl+H_2O\underrightarrow{^{to}}KOH+HCl\)
\(2KCl+3O_2\underrightarrow{^{to}}2KClO_3\)
Câu 2:
a,
Gọi a là mol NaCl; b là mol KBr
\(\Rightarrow58,5a+119b=23,7\left(1\right)\)
\(NaCl+AgNO_3\rightarrow AgCl+NaNO_3\)
\(KBr+AgNO_3\rightarrow AgBr+KNO_3\)
\(\Rightarrow143,5a+188b=42,55\left(2\right)\)
(1)(2) \(\Rightarrow\left\{{}\begin{matrix}a=0,1\\b=0,15\end{matrix}\right.\)
\(CM_{NaCl}=\frac{0,1}{0,2}=0,5M\)
\(CM_{KBr}=\frac{0,15}{0,2}=0,75M\)
b,\(Cl_2+2KBr\rightarrow2KCl+Br_2\)
\(n_{KCl}=n_{KBr}=0,15\left(mol\right)\)
\(\Rightarrow m_{muoi}=m_{NaCl}+m_{KCl}=17,025\left(g\right)\)