Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Na → Na+ + 1e; Cl + 1e → Cl-
Mg → Mg2+ + 2e; S + 2e → S2-
Al → Al3+ + 3e; O +2e → O2-

\(Na\rightarrow Na^++e\)
\(Mg\rightarrow Mg^{2+}+2e\)
\(Al\rightarrow Al^{3+}+3e\)
\(Cl+e\rightarrow Cl^-\)
\(S+2e\rightarrow S^{2-}\)
Cấu hình:
\(Na^+:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Mg^{2+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Al^{3+}:1s^22s^22p^6\) giống cấu hình của \(Ne\)
\(Cl^-:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)
\(S^{2-}:1s^22s^22p^63s^23p^6\) giống cấu hình của \(Ar\)

Cấu hình electron của các nguyên tử và các ion:
11Na : 1s22s22p63s1; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl : 1s22s22p63s23p5; Cl-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S : 1s22s22p63s23p4; S2-: 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al : 1s22s22p63s23p1; Al3+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O : 1s22s22p4; O2-: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.

a) Na (Z = 11) 1s22s22p63s1 ⇒ Na+: 1s22s22p6.
Cl (Z = 17) 1s22s22p63s23p5 ⇒ Cl-: 1s22s22p63s23p6.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp p của Cl. AO đó là AO chứa 1 electron.
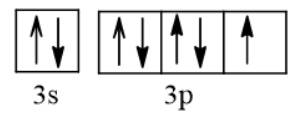

1/ Quá trình nhường - nhận electron.
\(Na^0\rightarrow Na^++e\)
\(Mg^0\rightarrow Mg^{2+}+2e\)
\(Ca^0\rightarrow Ca^{2+}+2e\)
\(F^0+e\rightarrow F^-\)
\(Cl^0+e\rightarrow Cl^-\)
\(O^0+2e\rightarrow O^{2-}\)
\(N^0+3e\rightarrow N^{3-}\)
\(S^0+2e\rightarrow S^{2-}\)
2/ Sự hình thành liên kết ion.
- Trong NaF:
+ Nguyên tử Na nhường 1e.
+ Nguyên tử F nhận 1e.
+ Nguyên tử Na và F tích điện trái dấu nên chúng hút nhau tạo thành phân tử NaF.
- Na2O, MgO, MgF2 giải thích tương tự.
3/ Đặc điểm của các hợp chất ion:
- Các hợp chất ion hầu hết là thể rắn ở nhiệt độ thường, khó tan chảy, khó bay hơi. Chẳng hạn, nhiệt độ nóng chảy của NaCl là 801 oC, nhiệt độ sôi của NaCl là 1465 oC.
- Khi các hợp chất này nóng chảy, hoặc hoà tan trong nước, lực hút tĩnh điện giữa các ion này yếu đi, kết quả là chúng phân li ra các ion trần, nên chúng dẫn điện tốt.
- Ở trạng thái rắn, các hợp chất ion không dẫn được điện.

a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.

Na → Na + + e
Mg → Mg 2 + + 2e
Al → Al 3 + + 3e
Cl + 1e → Cl -
O + 2e → O 2 -
S + 2e → S 2 -
a) Na -> Na+ + 1e ; Cl + 1e -> Cl-
Mg -> Mg2+ + 2e ; S + 2e -> S2-
Al -> Al3+ + 3e ; O + 2e -> O2-
b) Cấu hình electron của các nguyên tử và các ion:
11Na: 1s22s22p63s1 ; Na+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
17Cl: 1s22s22p63s23p5 ; Cl - : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
12Mg: 1s22s22p63s2 ; Mg2+: 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
16S: 1s22s22p63s23p4 ; S2- : 1s22s22p63s23p6
Cấu hình electron lớp ngoài cùng giống Ar.
13Al: 1s22s22p63s23p51 ; Al3+ : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.
8O: 1s22s22p4 ; O2- : 1s22s22p6
Cấu hình electron lớp ngoài cùng giống Ne.