K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Các câu hỏi dưới đây có thể giống với câu hỏi trên

23 tháng 11 2017
Đáp án C
Gọi công thức muối cần tìm là MX2.
Khi cho 150 gam dung dịch X tác dụng với dung dịch Na2CO3 dư có phản ứng:
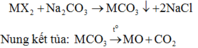
Do đó khí hấp thụ vào dung dịch KOH là CO2.
Vì sau phản ứng trong dung dịch vẫn còn KOH nên sản phẩm tạo thành là K2CO3:
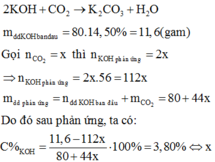 = 0,75
= 0,75

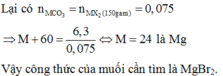

BT
Bùi Thế Nghị
Giáo viên
15 tháng 4 2021
nAgNO3 = 0,5.1,4 = 0,7 mol, nNaCl = 0,5.1 = 0,5 mol
a)
AgNO3 + NaCl → AgCl↓ + NaNO3
nAgNO3 > nNaCl => AgNO3 dư = 0,7 - 0,5 = 0,2 mol
chất rắn B là AgCl↓ = nNaCl = 0,5 mol
<=> mB = 0,5.143,5 = 71,75 gam
b.
Dung dịch A gồm NaNO3 0,5 mol và AgNO3 dư 0,2 mol
=> CNaNO3 = \(\dfrac{0,5}{0,5+0,5}\)= 0,5 M
CAgNO3 = \(\dfrac{0,2}{0,5+0,5}\) = 0,2 M
