Cho 15 gam hỗn hợp Al, Fe tác dụng với dung dịch NaOH dư. Sau khi các phản ứng xảy ra hoàn toàn thu được 6,72 lít khí (đktc). Phần trăm khối lượng Fe trong hỗn hợp là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
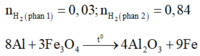
Vì phần 1 tác dụng với dung dịch NaOH có xuất hiện khí nên trong Y có Al dư.
Do đó Y gồm Fe, A12O3 và Al.

Khi cho phần 1 tác dụng với dung dịch NaOH dư có:
n Al = 2 3 n H 2 ⇒ a = 0 , 02
Khi cho phần 2 tác dụng với dung dịch HC1 dư:

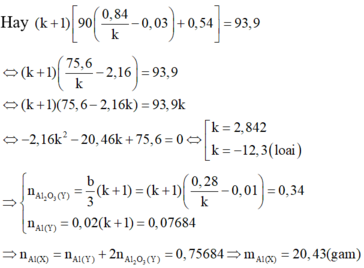

Đáp án A
nH2(ĐKTC) = 6,72:22,4 = 0,3 (mol)
Khi cho Fe và Al pư với dd NaOH chỉ có Al tham gia pư
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
0,2 ← 0,3 (mol)
=> nAl = 0,2 (mol) => mAl = 0,2.27 = 5,4 (g)
=> mFe = 13,8 – 5,4 = 8,4 (g)
%Fe = (8,4: 13,8).100% = 60,87%

Đáp án C
Các phản ứng xảy ra:
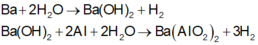
Khi cho m gam X tác dụng với dung dịch Ba (OH)2 dư thu được 20,832/2=10,416 lít H2 (đktc)
Vì thể tích H2 thu được ở hai trường hợp (khi sử dụng cùng khối lượng hỗn hợp X) khác nhau nên khi hòa tan hỗn hợp vào nước thì còn một phần kim loại Al dư không tan.
Trong m gam X gọi n Ba = a n Al = b
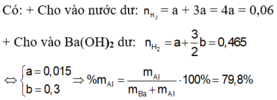

Giải thích: Đáp án B
Số mol H2 là 0,05 mol
PTHH: Fe + 2HCl → FeCl2 +H2
Suy ra nFe = 0,05 mol → mFe = 2,8 → %Fe = 56%

\(n_{Fe} = a(mol) ; n_{Mg} = b(mol)\\ \Rightarrow 56a + 24b = 16,8 - 6,4 = 10,4(1)\\ Fe + 2HCl \to FeCl_2 + H_2\\ Mg + 2HCl \to MgCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{6,72}{22,4} = 0,3(2)\)
Từ (1)(2) suy ra: a = 0,1 ; b = 0,2
Vậy :
\(\%m_{Fe} = \dfrac{0,1.56}{16,8}.100\% = 33,33\%\\ \%m_{Mg} = \dfrac{0,2.24}{16,8}.100\% = 28,57\%\\ \%m_{Cu} = 100\% - 33,33\% - 28,57\% = 38,1\%\)

Phần 2:
nH2 = 0,03 => nAl dư = 0,02
nNaOH = nAl dư + 2nAl2O3 => nAl2O3 = 0,08
Phần 1:
nAl dư = 0,02k; nAl2O3 = 0,08k; nFe = a
=> 0,02k.27 + 0,08k.102 + 56a = 9.39
nH2 = 0.02k.1,5 + a = 0,105
k = 0.5 và a = 0,09
Fe : O = a : (0,08k.3) => Fe3O4
m2 = 9,39 + 9,39/k =28,17g
\(Al+NaOH+H_2O\underrightarrow{t^o}NaAlO_2+\dfrac{3}{2}H_2\)
0.2 <--- 0.3
Fe không phản ứng với dung dịch NaOH
\(n_{H_2}=\dfrac{6.72}{22.4}=0.3mol\)
\(\%m_{Al}=\dfrac{0.2\times27\times100}{15}=36\%\)
\(\%m_{Fe}=100-36=64\%\)
Al+NaOH+H2Oto→NaAlO2+32H2Al+NaOH+H2Oto→NaAlO2+32H2
0.2 <--- 0.3
Fe không phản ứng với dung dịch NaOH
nH2=6.7222.4=0.3molnH2=6.7222.4=0.3mol
%mAl=0.2×27×10015=36%%mAl=0.2×27×10015=36%
%mFe=100−36=64%%mFe=100−36=64%
(Chắc thế)