Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03M thu được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 2.
B. 3.
C. 4
D. 1
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Cho V = 1 lít để xử lý cho dễ hiểu các bạn nhé !
Ta có
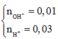
![]()
![]()

Đáp án A
nOH– = 0,01V mol; nH+ = 0,03V mol || H+ + OH– → H2O ⇒ H+ dư.
⇒ nH+ dư = 0,02V mol ⇒ [H+dư] = 0,02V ÷ 2V = 0,01
⇒ pH = -log0,01 = 2

\(n_{OH^-}=0.01\cdot10^{-3}\cdot V\left(mol\right)\)
\(n_{H^+}=0.03\cdot10^{-3}\cdot V\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(n_{H^+\left(dư\right)}=0.03\cdot10^{-3}V-0.01\cdot10^{-3}V=0.02\cdot10^{-3}V\left(mol\right)\)
\(\left[H^+\right]=\dfrac{0.02\cdot10^{-3}}{2}=0.01\cdot10^{-3}=10^{-5}\)
\(pH=-log\left(10^{-5}\right)=5\)
Đáp án A
nOH– = 0,01V mol; nH+ = 0,03V mol || H+ + OH– → H2O ⇒ H+ dư.⇒ nH+ dư = 0,02V mol ⇒ [H+dư] = 0,02V ÷ 2V = 0,01 ⇒ pH = -log0,01 = 2