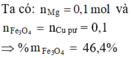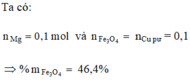Câu 6. Cho 12,7 gam hợp kim gồm Al, Cu và Mg vào dung dịch HCl dư. Sau phản ứng thu được 11,2 lít khí H2 (ở đktc) và 2,5 gam chất rắn
không tan và 200 ml dung dịch X.
a) Xác định thành phần phần trăm khối lượng của hợp kim.
b) Tính nồng độ mol/l của các chất tan trong dd X.
c) Cô cạn dung dịch X thu được m gam rắn khan. Tính m. (
d) Nếu hoà tan hoàn toàn 12,7g hợp kim trên trong dung dịch H2SO4 đặc, nóng thì sau phản ứng thu được bao nhiêu lít khí SO2 (đktc)?
e) Cho 25,4g hợp kim trên vào cố đựng dung dịch NaOH loãng, dư thì sau phản ứng thu được bao nhiêu lít khí (đktc)?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cu không tác dụng với axit HCl , do đó chất không tan là Cu và m Cu = 2,5 (gam).
Khối lượng Al và Mg bằng : 12,7 - 2,5 = 10,2 (gam)
Phương trình hoá học của phản ứng :
2Al + 6HCl → 2 AlCl 3 + 3 H 2
Mg + 2HCl → MgCl 2 + H 2
Theo phương trình hoá học trên và dữ kiện đề bài cho, ta có :
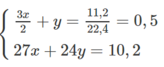
Giải ra, ta có : x = y = 0,2 mol
m Al = 0,2 x 27 = 5,4g
m Mg = 0,2 x 24 = 4,8g
% m Al = 5,4/12,7 .100% = 42,52%
% m Mg = 4,8/12,7 .100% = 37,8%
% m Cu = 100% - 42,52% - 37,8% = 19,68%

PTHH: 2Al + 6HCl → 2AlCl3 + 3H2 ↑
Mg + 2HCl → MgCl2 + H2 ↑
Cu + HCl → Không phản ứng
%Cu trong hỗn hợp kim loại là: (2,5:12,7).100% = 19,7%
Khối lượng hỗn hợp Al và Mg là: 12,7 - 2,5 = 10,2 gam
Gọi số mol của Al là 2a , số mol của Mg là b
Số mol của H2 là: 11,2 : 22,4 = 0,5 mol
Ta có hệ pt:
- 27 . 2a + 24b = 10,2
- 3a + b = 0,5
=> a = 0,1 mol ; b = 0,2 mol
Khối lượng Al là: 27 . 2a = 27 . 2 . 0,1 = 5,4 gam
% Al trong hỗn hợp KL là: (5,4:12,7).100% = 42,52%
%Mg trong hỗn hợp là: 100% - 42,52% - 19,7% = 37,78%

2Al + 6HCl → 2 A l C l 3 + 3 H 2
a……….3/2.a (mol)
Mg + 2HCl → M g C l 2 + H 2
b....................b (mol)
4 gam rắn không tan là Cu, gọi số mol của Al và Mg lần lượt là a và b (mol). Ta có:
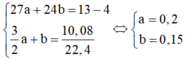
⇒ % m C u = 4 13 .100 = 30,77 % ⇒ % m A l = 0,2.27 13 .100 = 41,54 % ⇒ % m M g = 100 % − 30,77 % − 41,54 % = 27,69 %
⇒ Chọn C.

Không viết phương trình nhá !!
a) Gọi a và b lần lượt là số mol của Mg và Al
\(\Rightarrow24a+27b=1,035\) (1)
Ta có: \(n_{H_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\)
Bảo toàn electron: \(2a+3b=2\cdot0,0525\) (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,015\cdot24}{1,035}\cdot100\%\approx34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) Ta có: \(\left\{{}\begin{matrix}\Sigma n_{H_2SO_4}=\dfrac{100\cdot9,8\%}{98}=0,1\left(mol\right)\\n_{H_2SO_4\left(p/ứ\right)}=n_{H_2}=0,0525\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,0475\left(mol\right)\) \(\Rightarrow m_{H_2SO_4\left(dư\right)}=0,0475\cdot98=4,655\left(g\right)\)
c) Bảo toàn nguyên tố: \(\left\{{}\begin{matrix}n_{Al_2O_3}=\dfrac{1}{2}n_{Al}=0,0125\left(mol\right)\\n_{MgO}=n_{Mg}=0,015\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{oxit}=0,0125\cdot102+0,015\cdot40=1,875\left(g\right)\)
a) Gọi \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(m_A=1,035\left(g\right)\rightarrow24a+27b=1,035\) (1)
\(Mg+2H_2SO_4đ\rightarrow MgSO_4+SO_2+2H_2O\)
a ------------ 2a ----------------------- a (mol)
\(2Al+6H_2SO_4đ\rightarrow Al_2\left(SO_4\right)_3+3SO_2+6H_2O\)
b ------------ 3b -------------------------- 1,5b (mol)
\(n_{SO_2}=\dfrac{1,176}{22,4}=0,0525\left(mol\right)\rightarrow a+1,5b=0,0525\) (2)
Giải hệ (1)(2) \(\rightarrow\left\{{}\begin{matrix}a=0,015\\b=0,025\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Mg}=0,015.24=0,36\left(g\right)\\m_{Al}=0,025.27=0,675\left(g\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Mg}=34,78\%\\\%m_{Al}=65,22\%\end{matrix}\right.\)
b) \(\Sigma_{n_{H_2SO_4}}=2a+3b=0,105\left(mol\right)\)
\(\rightarrow m_{H_2SO_4}=0,105.98=10,29\left(g\right)\)
c. \(\left\{{}\begin{matrix}n_{MgO}=n_{Mg}=0,015\left(mol\right)\\n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=0,0125\left(mol\right)\end{matrix}\right.\)
\(\rightarrow m_{oxit}=0,015.40+0,0125.102=1,875\left(g\right)\)