Dẫn hỗn hợp X gồm CnH2n và H2 (số mol bằng nhau) qua Ni, to thu được hỗn hợp Y. Tỉ khối hơi của Y so với X là 1,6. Hiệu suất của phản ứng là
A. 40%.
B. 60%.
C. 65%.
D. 75%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Giả sử ban đầu có 1 mol anken và 1 mol H2.
Gọi số mol anken và H2 phản ứng là x mol.
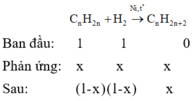
Ta có:
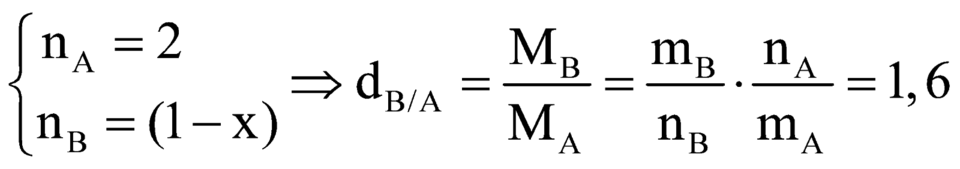 (1)
(1)
Áp dụng định luật bảo toàn khối lượng ta có: mA = mB
Từ (1)
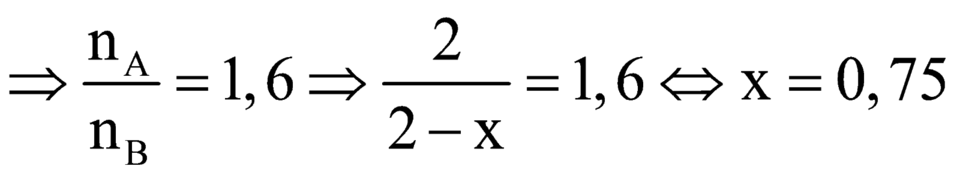
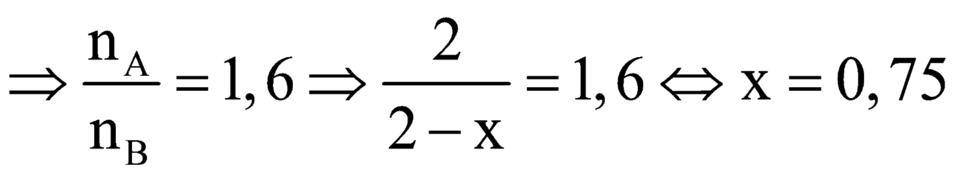

Chọn A.
Giả sử số mol H2 và C3H6 trước phản ứng đều là 1 mol.
Số mol C3H6 hoặc H2 đã phản ứng là: x = 1.40% = 0,4 mol.
nhhA = 1 + 1 = 2 mol; nhhB = (2 - 0,4) = 1,6 mol.
d B / A = M B - M A - = m B n B . n A m A = 2 1 , 6 = 1 , 25
(Vì mA = mB: định luật bảo toàn khối lượng)

Đáp án A
• Coi hhX ban đầu có x mol CH2=CH2 và y mol H2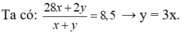
Coi hh ban đầu gồm 1 mol CH2=CH2 và 3 mol H2.
• hhY gồm 0,75 mol C2H6; (1 - 0,75) mol C2H4 và (3 - 0,75) mol H2
→ ∑nY = 0,75 + (1 - 0,75) + (3 - 0,75) = 3,25 mol.
Theo BTKL: mY = mX = 1 x 28 + 3 x 2 = 34 gam
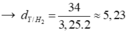

Bài 16 :
Giả sử ban đầu có 1 mol X
Gọi số mol C2H4 và H2 là a và b
\(\left\{{}\begin{matrix}a+b=1\\\frac{28a+2b}{a+b}=4,25.2\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=1\\28a+2b=8,5\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=0,25\\b=0,75\end{matrix}\right.\)
\(PTHH:C_2H_4+H_2\rightarrow C_2H_6\)
Trước ___0,25___ 0,75_________
Phứng___a___________________
Tỉ lệ : \(n_{C2H4}< n_{H2}\)
Hiệu suất tính theo C2H4
Gọi số mol C2H4 phản ứng là a
\(\frac{a}{0,25}=75\%\)
\(\Rightarrow a=0,1875\)
\(PTHH:C_2H_4+O_2\rightarrow C_2H_6\)
Trước _0,25_____0,75____________
Phứng_0,1875___ 0,1875_________
Sau____0,0625___ 0,5625___0,1875
Sau phản ứng, số mol hỗn hợp:
\(n=0,0625+0,5625+0,1875=0,8125\)
Khối lượng hỗn hợp:msau = m trước = 8,5
\(M_Y=\frac{8,5}{0,8125}=\frac{136}{13}\)
Tỉ khối so với H2 \(=\frac{136}{13}:2=5,28\)
Bài 17 :
Gọi công thức anken là CnH2n
Giả sử ban đầu nCnH2n = nH2 = 1mol
Số mol hỗn hợp ban đầu là 1 + 1 = 2
Gọi số mol phản ứng là a mol
\(PTHH:C_nH_{2n}+H_2\rightarrow C_nH_{2n+2}\)
Trước _____1______1____________
Phứng _____a______ a
Sau ______1 - a ____ 1 - a_________ a
Số mol hỗn hợp sau phản ứng=1 - a + 1 - a + a = 2 - a
\(\frac{M_B}{M_A}=1,6\)
\(\Rightarrow\frac{m_B:n_B}{m_A:n_A}=1,6\)
Mà khối lượng sau phản ứng không thay đổi
Hay mB = mA
\(\Rightarrow\frac{n_A}{n_B}=1,6\)
\(\frac{2}{2-a}=1,6\)
\(\Rightarrow a=0,75\)
Hiệu suất phản ứng: \(H=\frac{a}{1}=\frac{0,75}{1}=75\%\)
Bài 18 :
\(M_X=9,25.2=18,5\)
\(n_X=\frac{22,4}{22,4}=1\left(mol\right)\)
\(m_X=18,5.1=18,5\left(g\right)\)
Theo bảo toàn khối lương:
mX = mY = 18,5
\(M_Y=10.2=20\)
\(\Rightarrow n_Y=\frac{18,5}{20}=0,925\)
Ta có: n khí giảm chính là nH2 phản ứng
\(\Rightarrow n_{H2_{pư}}=1-0,925=0,075\left(mol\right)\)

Đáp án : A
Ta có : MY = 46,4g
Gọi CT anken là CnH2n và giả sử số mol 2 chất ban đầu là 1 mol
=> MCnH2n+2 = 14n + 2 > MY = 46,4 => n > 3,17
Mà anken thể khí => n ≤4 => n = 4
CnH2n + H2 à CnH2n+2
x à x à x mol
=> nY = 2- x mol
=> Bảo toàn khối lượng : mX = mY => 2 + 14n = (2 – x).46,4
=> x = 0,75 mol
=> H = 75%

Đáp án B
Đáp án
Gọi a, b là số mol C2H4 và H2 trước phản ứng.
Ta có: 28 a + 2 b a + b = 4,25.2 = 8,5
<=> 28a + 2b = 8,5a + 8,5b <=> 19,5a = 6,5b => a = b 3 hay b = 3a
PTPU: C2H4 + H2 → N i , t 0 C2H6
Trước p/ư: a 3a
P/ư: 0,75a 0,75a
Sau p/ư: 0,25a 2,25a 0,75a
d Y H 2 = 0 , 25 . a . 28 + 2 , 25 . a . 2 + 0 , 75 . 3 a 3 , 25 a . 2
= 5,23

Đáp án D
hhX gồm H2 và C2H4 có dX/H2 = 7,5.
Dẫn X qua Ni, to → hhY có dY/H2 = 12,5.
• Đặt nH2 = x mol; nC2H4 = y mol.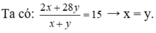
Đặt nH2 = 1 mol; nC2H4 = 1 mol.
Giả sử có x mol C2H6 tạo thành → hhY gồm C2H6 x mol; H2 (1 - x) mol và C2H4 (1 - x) mol.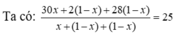
→ x = 0,8 → H = 80%

Đáp án C
Giả sử hỗn hợp X chứa 1 mol → nH2 = 0,8 mol, nC2H2 = 0,2 mol
Luôn có mX = mY → nY =
1
.
3
,
6
.
2
4
.
2
= 0,9 mol
Nhận thấy nH2 pu = nC2H4 pu = nX - nY = 1- 0,9 = 0,1 mol
→ H = 0 , 1 0 , 2 ×100% = 50%.
Đáp án D
Giả sử hhX gồm 1 mol CnH2n và 1 mol H2.
hhY gồm x mol CnH2n + 2; (1 - x) mol CnH2n và (1 - x) mol H2.
Theo BTKL: mX = mY