Điện phân 150ml dung dịch AgNO3 1M với điện cực trơ trong thời gian t giờ, cường độ dòng điện không đổi bằng 2,68A (hiệu suất quá trình điện phân là 100%), thu được chất rắn X, dung dịch Y và khí Z. Cho 12,6 gam Fe vào dung dịch Y, sau khi các phản ứng kết thúc thu được 14,5 gam hỗn hợp kim loại và khí NO (sản phẩm khử duy nhất của N+5. Giá trị của t là:
A. 1,20
B. 0,30
C. 0,80
D. 1,0


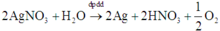
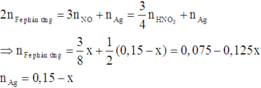
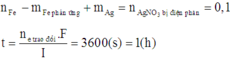

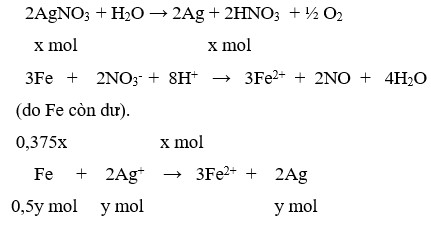
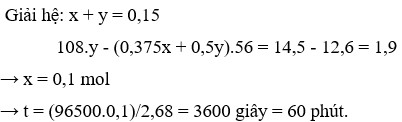
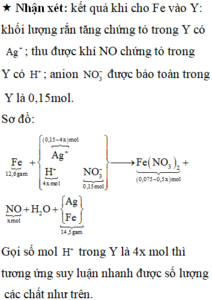


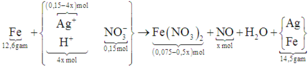

Chọn đáp án D