Chia 7,72 gam hỗn hợp X gồm Fe và hai oxit kim loại MO, R2O3 thành hai phần bằng nhau. Dùng một lượng vừa đủ dung dịch H2SO4 loãng hòa tan hoàn toàn phần 1, thu được khí B và dung dịch D chứa 9,7 gam muối. Dẫn toàn bộ lượng khí B sinh ra qua ống đựng 1,6 gam CuO nung nóng, đến khi thu được 1,408 gam chất rắn thì đã có 80% lượng khí B tham gia phản ứng. Mặt khác, dẫn dòng khí CO dư qua phần 2 nugn nóng, sau khi phản ứng xảy ra hoàn toàn thu được 3,46 gam chất rắn. Biết rằng nguyên tử khối của M gấp 2,37 lần nguyên tử khối của R. Cho các phản ứng được thực hiện trong điều kiện không có không khí. Xác định 2 kim loại M, R và tính % khối lượng các chất trong hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Gọi x, y lần lượt là số mol Al, Fe
Theo đề bài ta có hệ pt
\(\left\{{}\begin{matrix}27x+56y=8,3\\\dfrac{3}{2}x+y=\dfrac{5,6}{22,4}=0,25\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
a)\(x=\dfrac{\dfrac{0,1.3}{2}+0,1}{0,2}=0,25M\)
b)\(\%m_{Al_2(SO_4)_3}=\dfrac{\dfrac{0,1}{2}.342}{\dfrac{0,1}{2}.342+0,1.152}.100=52,94\%\)
=> %mFeSO4=100-52,94=47,06%
c)\(CM_{Al_2(SO_4)_3}=\dfrac{0,05}{0,2}=0,25M\)
\(CM_{FeSO_4}=\dfrac{0,1}{0,2}=0,5M\)
d) 1> Thu được kết tủa bé nhất
-TH1 : Lượng KOH chỉ phản ứng với FeSO4 tạo kết tủa, không đủ để tạo kết tủa với Al2(SO4)3
\(2KOH+FeSO_4\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
=> \(m_{ddKOH}=\dfrac{0,1.2.56}{15\%}=74,67\left(g\right)\)
TH2: Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 sau đó tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
\(Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6+0,1\right).56}{15\%}=224\left(g\right)\)
2> Thu được kết tủa lớn nhất :
Lượng KOH phản ứng với FeSO4 tạo kết tủa và tạo kết tủa với Al2(SO4)3 và không tan kết tủa của Al2(SO4)3
\(2KOH+FeSO_4\rightarrow K_2SO_4+Fe\left(OH\right)_2\)
\(6KOH+Al_2(SO_4)_3\rightarrow2Al\left(OH\right)_3+3K_2SO_4\)
=>\(m_{ddKOH}=\dfrac{\left(0.1.2+0,05.6\right).56}{15\%}=186,67\left(g\right)\)
Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(\left(mol\right)\) \(a\) \(1,5a\) \(0,5a\) \(1,5a\)
\(PTHH:Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\left(mol\right)\) \(b\) \(b\) \(b\) \(b\)
Ta có hpt: \(\left\{{}\begin{matrix}27a+56b=8,3\\1,5a+b=\dfrac{5,6}{22,4}\end{matrix}\right.\Leftrightarrow a=b=0,1\left(mol\right)\)
\(a.x=\dfrac{1,5a+b}{0,2}=\dfrac{0,15+0,1}{0,2}=1,25\left(M\right)\\ b.\%m_{Al}=\dfrac{27.0,1}{8,3}.100=32,53\left(\%\right)\\ \%m_{Fe}=100-32,53=67,47\left(\%\right)\\ c.C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,5a}{0,2}=0,25\left(M\right)\\ C_{M_{FeSO_4}}=\dfrac{b}{0,2}=0,5\left(M\right)\\ d.\)
\(PTHH:Al_2\left(SO_4\right)_3+6KOH\rightarrow3K_2SO_4+2Al\left(OH\right)_3\)
\(\left(mol\right)\) \(0,05\) \(0,3\) \(0,1\)
\(PTHH:FeSO_4+2KOH\rightarrow Fe\left(OH\right)_2+K_2SO_4\)
\(\left(mol\right)\) \(0,1\) \(0,2\)
\(PTHH:Al\left(OH\right)_3+KOH\rightarrow KAlO_2+2H_2O\)
\(\left(mol\right)\) \(0,1\) \(0,1\)
\(d.1.\) Lượng kết tủa bé nhất khi kết tủa \(Al\left(OH\right)_3\) sinh ra tan hết trong dd KOH
Khi đó: \(n_{KOH}=0,6\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,6.100.56}{15}=224\left(g\right)\)
\(d.2.\) Lượng kết tủa lớn nhất khi KOH tác dụng vừa đủ với dd A
Khi đó: \(n_{KOH}=0,5\left(mol\right)\rightarrow m_{ddKOH}=\dfrac{0,5.56.100}{15}=186,67\left(g\right)\)

a, Ta có: 27nAl + 56nFe = 27,8 (1)
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{17,353}{24,79}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,4\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,2.27}{27,8}.100\%\approx19,42\%\\\%m_{Fe}\approx80,58\%\end{matrix}\right.\)
b, \(n_{H_2SO_4}=n_{H_2}=0,7\left(mol\right)\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,7}{0,5}=1,4\left(M\right)\)

Gọi số mol H2O sinh ra là a (mol)
=> \(n_{H_2SO_4}=a\left(mol\right)\)
Theo ĐLBTKL: moxit + mH2SO4 = mmuối + mH2O
=> 16,6 + 98a = 24,6 + 18a
=> a = 0,1 (mol)
=> nO = 0,1 (mol)
=> mkim loại = 16,6 - 0,1.16 = 15 (g)
\(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)

Đáp án B
Gọi M là kim loại chung cho các kim loại trong X với hóa trị n
Khí thu được là


Đáp án C
![]()
Bảo toàn khối lượng: 3,22 + 0,06.98 = m + 0,06.2
m = 8,98 gam




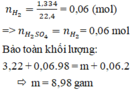

m rắn giảm = mO (oxit) => nO (oxit) = (1,6 – 1,408) : 16 = 0,012mol
Dễ thấy n = nO (oxit) = 0,012mol
=> nH2 ban đầu = 0,012 : 80% = 0,015
=> nFe = nH2= 0,015 → x = 0,015
Ta có: CO + O(Oxit) → CO2
Vì: m(Rắn giảm) = mO(Oxit) → nO(Oxit) = (3,86 – 3,46) : 16 = 0,025
TH1: cả 2 oxit đều bị khử bởi CO
→ nO(Oxit) = y + 3z = 0,025 kết hợp với (1) loại
TH2: chỉ có MO bị khử bởi CO
→ nO(Oxit) = nMO = 0,025 → y = 0,025 kết hợp với (1) => z = 0,01
Kết hợp với (*) => M = 64 (Cu)
TH3: chỉ có R2O3 bị khử bởi CO
→ nO(Oxit) = 3.nR2O3 → z = 0,025/3 kết hợp với (1) => y = 0,03
Kết hợp với (*) y => M lẻ => loại
Vậy %m các chất trong X là: 21,76%; 51,81%; 26,43%