Hòa tan 7,86g hỗn hợp kim loại Cu, Fe trong axit HCl dư 3,024 lít H2 và 1,68g chất rắn không tan
a) viết phương trình hóa học xảy ra
b) tính thành phần phần trăm khối lượng của từng kim loại trong hỗn hợp trên
Mọi người giúp em với em đang cần gấp ạ.

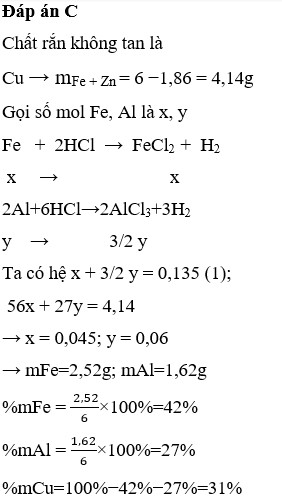
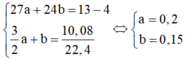
sai đề
xem lại đề hơi thiếu j đó hay là đề đúng là như vậy