1.Cho m g hỗn hợp fe và zn tác dụng vừa hết vs dung dịch hcl 2,5 M ( D=1,19g/ml ) thấy thoát ra 1 chất khí và thu đc 1200g đungịch xác định m
2. cho 2 mẩu fe có khối lượng bằng nhau . cho 1 mẩu hào tan hòa toàn trong dung dịch hcl tạo 19.05g muối . cho mẩu còn lại tan hòa toàn trong dung dịch h2so4 loãng thì khối lượng muối sắt tạo thành là bao nhiêu




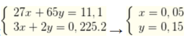
bài 2 :
Khi cho 1 mẫu sắt hòa tan hoàn toàn vào dd HCl thì muối thu được là FeCl2
=> mFeCl2=19,05(g) => nFeCl2=0,15(mol)
PTHH :(1)
Fe + 2HCl \(\rightarrow\) FeCl2 + H2 \(\uparrow\)
0,15mol..........0,15mol
=> mFe\(_{\left(m\text{ẫu}-1\right)}=0,15.56=8,4\left(g\right)\)
Vì 2 mẫu sắt có khối lượng bằng nhau nên Khi cho mẫu còn lại vào dd H2SO4 thì : Khối lượng của mẫu sắt 2 là :
mFe\(_{\left(m\text{ẫu}-2\right)}=mFe_{\left(m\text{ẫu}-1\right)}=8,4\left(g\right)\)
Khối lượng bằng nhau => nFe2=nFe1=0,15 mol
PTHH : (2)
Fe + H2SO4 \(\rightarrow\)\(\) FeSO4 + H2 \(\uparrow\)
0,15mol.............0,15mol
=> mFeSO4=0,15.152=22,8(g)
Vậy........