Đốt cháy 11,2 gam sắt trong bình chứa 22,4 lít khí oxi ( đktc ) tạo thành sắt từ oxit ( Fe3O4 )
a) Viết PTHH
b) Tính số mol mỗi chất trước phản ứng
c) Tính khối lượng chất dư sau phản ứng
d) Tính khối lượng Fe3O4 thu được

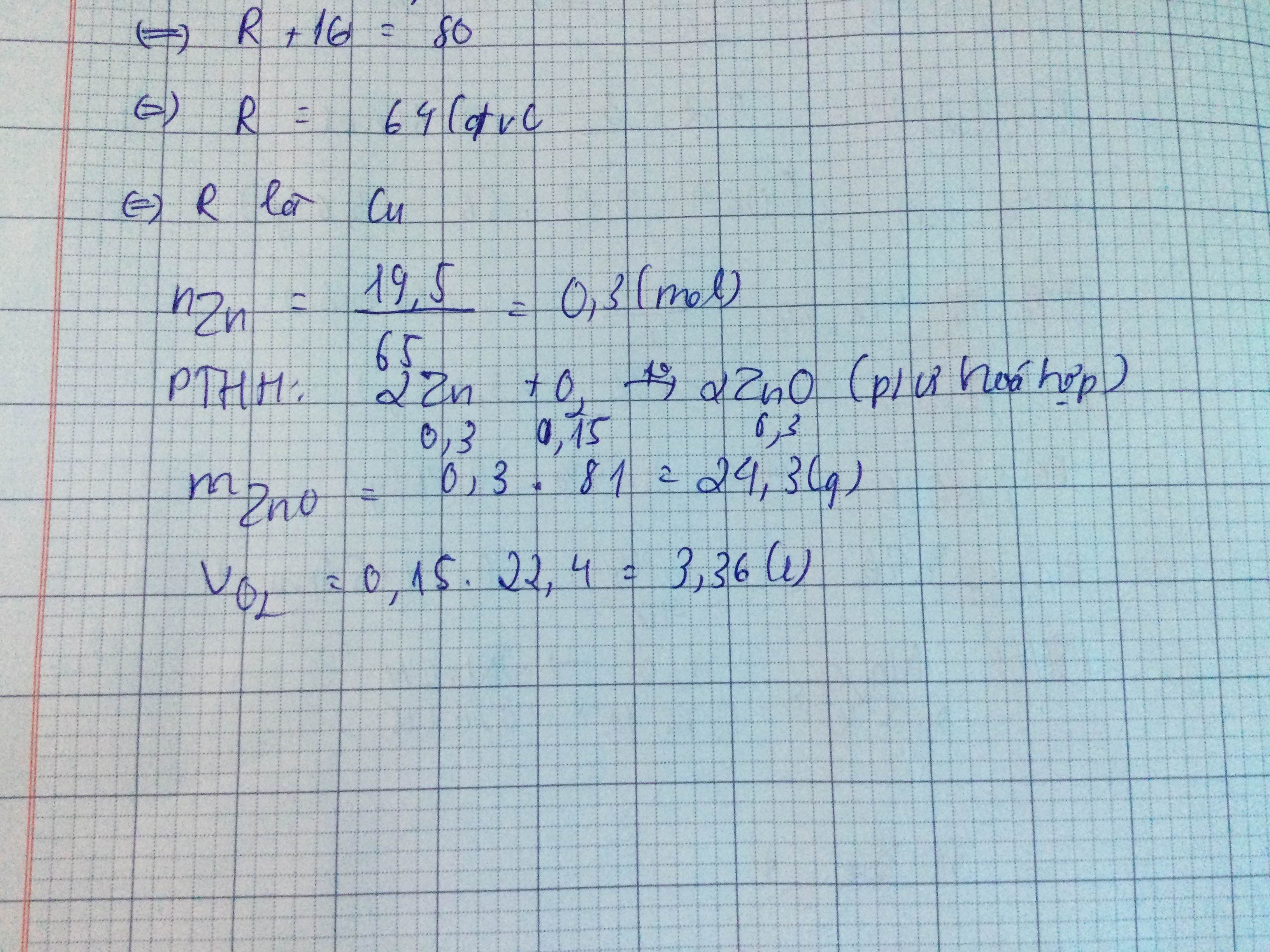
a) PTHH: 3Fe + 2O2 =(nhiệt)=> Fe3O4
b) Số mol Fe: nFe = \(\frac{11,2}{56}=0,2\left(mol\right)\)
Số mol O2: nO2 = \(\frac{22,4}{22,4}=1\left(mol\right)\)
c) Lập tỉ lệ : \(\frac{0,2}{3}< \frac{1}{2}\)
=> Fe hết, O2 dư
=> nO2(phản ứng) = \(\frac{0,2.2}{3}=\frac{2}{15}\left(mol\right)\)
=> nO2(dư) = \(1-\frac{2}{15}=\frac{13}{15}\left(mol\right)\)
=> mO2 = \(\frac{13}{15}.32=27,73\left(gam\right)\)
d) nFe3O4 = \(\frac{0,2}{3}=\frac{1}{15}\left(mol\right)\)
=> mFe3O4 = \(\frac{1}{15}.232=15,47\left(gam\right)\)
nFe= \(\frac{m_{Fe}}{M_{Fe}}=\frac{11,2}{56}=0,2\left(mol\right)\)
\(n_{O_2}=\frac{V_{O_2}}{22,4}=\frac{22,4}{22,4}=1\left(mol\right)\)
PTHH: 3Fe + 2O2 -to> Fe3O4
Theo PTHH và đề bài ta có:
\(\frac{n_{Fe\left(đềbài\right)}}{n_{Fe\left(PTHH\right)}}=\frac{0,2}{3}\approx0,067< \frac{n_{O\left(đềbài\right)}}{n_{O_2\left(PTHH\right)}}=\frac{1}{2}=0,5\)
=> Fe đã phản ứng hết và O2 dư nên tính theo nFe.
c) \(n_{O_2\left(phảnứng\right)}=\frac{2}{3}.n_{Fe}=\frac{2}{3}.0,2=0,133\left(mol\right)\)
\(n_{O_2\left(dư\right)}=n_{O_2\left(banđầu\right)}-n_{O_2\left(phảnứng\right)}=0,5-0,133=0,367\left(mol\right)\)
=> \(m_{O_2\left(dư\right)}=n_{O_2\left(dư\right)}.M_{O_2}=0,367.32\approx11,744\left(g\right)\)
d) Theo PTHH và đề bài, ta có:
\(n_{Fe_3O_4}=\frac{1}{3}.n_{Fe}=\frac{1}{3}.0,2\approx0,067\left(mol\right)\)
=> \(m_{Fe_3O_4}=n_{Fe_3O_4}.M_{Fe_3O_4}=0,067.232=15,544\left(g\right)\)