cho hỗn hợp gồm 5,4g một kim loại A và 3,6g Mg tác dụng vừa đủ với 450ml dd H2SO4 loãng thu được 10,08 lít hidro
a) xác định tên nguyên tố A
b)xác định nồng độ mol của dd H2SO4 và đ thu được sau phản ứng(giả sử thể tích dd không đổi)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

a)
\(n_{H_2\left(1\right)}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2 (1)
0,6<----------------------0,3
=> mNa = 0,6.23 = 13,8 (g)
PTHH: Fe + 2HCl --> FeCl2 + H2
0,1<-0,2
=> mFe = 0,1.56 = 5,6 (g)
mCu = 10 (g)
\(\left\{{}\begin{matrix}\%Na=\dfrac{13,8}{13,8+5,6+10}.100\%=46,94\%\\\%Fe=\dfrac{5,6}{13,8+5,6+10}.100\%=19,05\%\\\%Cu=\dfrac{10}{13,8+5,6+10}.100\%=34,01\%\end{matrix}\right.\)
b)
PTHH: FexOy + yH2 --to--> xFe + yH2O
\(\dfrac{0,3}{y}\)<--0,3
=> \(M_{Fe_xO_y}=\dfrac{17,4}{\dfrac{0,3}{y}}=58y\left(g/mol\right)\)
=> 56x = 42y
=> \(\dfrac{x}{y}=\dfrac{3}{4}\) => CTHH: Fe3O4

a)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,6<----------------------0,3
Fe + 2HCl --> FeCl2 + H2
0,1<--0,2
=> \(\left\{{}\begin{matrix}m_{Na}=0,6.23=13,8\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\\m_{Cu}=10\left(g\right)\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%m_{Na}=\dfrac{13,8}{13,8+5,6+10}.100\%=46,94\%\\\%m_{Fe}=\dfrac{5,6}{13,8+5,6+10}.100\%=19,05\%\\\%m_{Cu}=\dfrac{10}{13,8+5,6+10}.100\%=34,01\%\end{matrix}\right.\)
b)
PTHH: FexOy + yH2 --to--> xFe + yH2O
\(\dfrac{0,3}{y}\)<--0,3
=> \(M_{Fe_xO_y}=56x+16y=\dfrac{17,4}{\dfrac{0,3}{y}}\left(g/mol\right)\)
=> \(\dfrac{x}{y}=\dfrac{3}{4}\)
=> CTHH: Fe3O4

a, \(n_{H_2}=0,09\left(mol\right)\)
BT e, có: 2nX = 2nH2 ⇒ nX = 0,09 (mol)
\(\Rightarrow\overline{M}_X=\dfrac{2,64}{0,09}=29,33\left(g/mol\right)\)
Mà: A, B thuộc 2 chu kì liên tiếp.
→ Mg và Ca.
Ta có: \(\left\{{}\begin{matrix}24n_{Mg}+40n_{Ca}=2,64\\2n_{Mg}+2n_{Ca}=0,09.2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,06\left(mol\right)\\n_{Ca}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,06.24}{2,64}.100\%\approx54,55\%\\\%m_{Ca}\approx45,45\%\end{matrix}\right.\)
b, BTNT H, có: \(n_{H_2SO_4}=n_{H_2}=0,09\left(mol\right)\Rightarrow V_{ddH_2SO_4}=\dfrac{0,09}{2}=0,045\left(l\right)\)
BTNT Mg: nMgSO4 = nMg = 0,06 (mol)
\(\Rightarrow C_{M_{MgSO_4}}=\dfrac{0,06}{0,045}=\dfrac{4}{3}\left(M\right)\)

a) Đặt số mol của MO, M(OH)2, MCO3 tương ứng là x, y, z.
Nếu tạo muối trung hòa ta có các phản ứng:
MO + H2SO4 →MSO4 + H2O (1)
M(OH)2 + H2SO4 →MSO4 + 2H2O (2)
MCO3 + H2SO4 →MSO4 + H2O + CO2 (3)
Nếu tạo muối axít ta có các phản ứng:
MO + 2H2SO4 →M(HSO4)2 + H2O (4)
M(OH)2 + 2H2SO4 →M(HSO4)2 + 2H2O (5)
MCO3 + 2H2SO4 →M(HSO4)2 + H2O + CO2 (6)
Ta có :
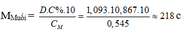
– TH1: Nếu muối là MSO4 M + 96 = 218 M = 122 (loại)
– TH2: Nếu là muối M(HSO4)2 M + 97.2 = 218 M = 24 (Mg)
Vậy xảy ra phản ứng (4, 5, 6) tạo muối Mg(HSO4)2
b) Theo (4, 5, 6) Số mol CO2 = 0,448/22,4 = 0,02 molz = 0,02 (I)
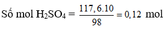
2x + 2y + 2z = 0,12 (II)
Đề bài: 40x + 58y + 84z = 3,64 (III)
Giải hệ (I, II, III): x = 0,02; y = 0,02; z = 0,02
%MgO = 40.0,02.100/3,64 = 21,98%
%Mg(OH)2 = 58.0,02.100/3,64 = 31,87%
%MgCO3 = 84.0,02.100/3,64 = 46,15%

PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
a_______a_______a_____a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
2b______3b__________b_____3b (mol)
Ta lập HPT: \(\left\{{}\begin{matrix}56a+27\cdot2b=11\\a+3b=0,2\cdot2=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,1\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,1\cdot56}{11}\cdot100\%\approx50,91\%\\\%m_{Al}=49,09\%\end{matrix}\right.\)
Theo các PTHH: \(\left\{{}\begin{matrix}n_{H_2}=0,4\left(mol\right)\\n_{FeSO_4}=0,1\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,4\cdot22,4=8,96\left(l\right)\\C_{M_{FeSO_4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\\C_{M_{Al_2\left(SO_4\right)_3}}=\dfrac{0,3}{0,2}=1,5\left(M\right)\end{matrix}\right.\)
a) nH2SO4=0,4(mol)
Đặt: nFe=x(mol); nAl=y(mol) (x,y>0)
PTHH: Fe + H2SO4 -> FeSO4 + H2
x________x______x______x(mol)
2Al + 3 H2SO4 -> Al2(SO4)3 + 3 H2
y____1,5y_______0,5y_______1,5y(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
=> mFe=0,1.56=5,6(g)
=>%mFe=(5,6/11).100=50,909%
=>%mAl= 49,091%
b) V(H2,đktc)=0,4.22,4=8,96(l)
c) nAl2(SO4)3= 0,5y=0,5.0,2=0,1(mol)
nFeSO4=x=0,1(mol)
Vddsau=VddH2SO4=0,2(l)
=>CMddAl2(SO4)3= 0,1/0,2=0,5(M)
CMddFeSO4=0,1/0,2=0,5(M)
a/ nH2 = \(\frac{10,08}{22,4}=0,45\left(mol\right)\) ; nMg = \(\frac{3,6}{24}=0,15\left(mol\right)\)
Gọi y là số mol H2 sinh ra sau khi cho kim loại A tác dụng H2SO4 , x là hóa trị của kim loại A
2A + xH2SO4 -----> A2(SO4)x +xH2
(mol) 2y/x y
Mg + H2SO4 ------> MgSO4 + H2
(mol) 0,15 0,15
=> \(0,15+y=0,45\Leftrightarrow y=0,3\)
nA = \(\frac{0,6}{x}\) => MA = \(\frac{5,4}{\frac{0,6}{x}}=9x\)
Vì kim loại chỉ có thể có hóa trị I,II,III nên :
Vậy A là Al
b/
2A + xH2SO4 -----> A2(SO4)x +xH2
(mol) 2y/x y y
Mg + H2SO4 ------> MgSO4 + H2
(mol) 0,15 0,15 0,15
Từ pt ta có nH2SO4 = 0,15 + 0,3 = 0,45 (mol)
=> CM = \(\frac{0,45}{\frac{450}{1000}}=1\) (mol/l)