Cần thêm bao nhiêu lần thể tích nước (V2) so với thể tích ban đầu (V1) để phá loãng dd pH=3 thành dd có pH=4 ???
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Cách 1: pH=8 => KOH dư
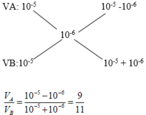
Cách 2: Do O H - dư nên ta có:
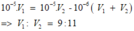

Đáp án A
pH lúc sau = 3 ⇒ [H+] đầu = 10[H+]M lúc sau
⇒ V2 + V1 = 10V1 ⇒ V2 = 9V1
Đáp án A.

Câu 1 :
Gọi thể tích dung dịch ban đầu là V(lít)
$[H^+] = 10^{-3}V(mol)$
Thể tích dung dịch lúc sau là :
$V' = \dfrac{10^{-3}.V}{10^{-4}} = 10V$
Do đó cần pha loãng dung dịch ban đầu 10 lần thì thu được dung dịch trên

nZn = 13 : 65 = 0,2 (mol)
nHCl= 7,3 : 36,5 = 0,2 (mol)
pthh : Zn + 2HCl --> ZnCl2 + H2
LTL
0,2/1 <0,2/2 => HCl DƯ
theo pt : nZn =nH2 = 0,2 (mol)
=> VH2 = 0,2.22,4 = 4,48 (l)
a, nZn = 13/65 = 0,2 (mol)
nHCl = 7,3/36,5 = 0,2 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
LTL: 0,2 > 0,2/2 => Zn dư
nH2 = 0,2/2 = 0,1 (mol)
V1 = VH2 = 0,1 . 22,4 = 2,24 (l)
b, V2 = 3/2 . 0,1 = 0,15 (mol)
VH2 (LT) = 0,15/80% = 0,1875 (mol)
PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2
nAl = 0,1875 : 3 . 2 = 0,125 (mol)
mAl = 0,125 . 27 = 3,375 (g)

\(\left[H+\right]\) ban đầu \(=10^{-3}=0,001\)
\(\left[H+\right]\) lúc sau \(=10^{-4}=0,0001\)
Ta có :
\(\left[H+\right]\) ban đầu \(\times\) \(V\) ban đầu = \(\left[H+\right]\) lúc sau \(\times\) \(V\) sau
\(\frac{Vsau}{Vđầu}=\frac{\left[H+\right]đầu}{\left[H+\right]sau}=\frac{0,001}{0,0001}=10\) lần

pH=12 => nOH-= 10-2 * 0,3 = 0,003 (mol)
để trung hòa thì: nH+ = nOH- = 0,003 => Vdd HCl = 0,003/10-3 = 3 (l)
dd sau khi cô cạn: K+ a (mol) , Na+ b (mol) , Cl- 0,003 (mol)
lập đc hệ: a + b = 0,003
39a + 23b = 0,1915 - 0,003 * 35,5
=> a= 0,001 , b= 0,002

Số mol không đổi, nồng độ và thể tích đổi
--> Cm1 x V1 = Cm2 x V2
=> V2 \ V1 = Cm1 \ Cm2 = 10^¯3 \ 10^¯4= 10(lần) ( bạn tự suy ra nồng độ H+ nhé)
Số mol không đổi, nồng độ và thể tích đổi
--> Cm1 x V1 = Cm2 x V2
=> V2 \ V1 = Cm1 \ Cm2 = 10^¯3 \ 10^¯4= 10(lần) ( bạn tự suy ra nồng độ H+ nhé)
2)Cũng tương tự: Cm1 x V1 = Cm2 x V2
=> V2 = (Cm1 x V1 )\Cm2 = (10^¯3 x 0.01)\10^¯4=0.1(lít) = 100 ml
Vậy phải lấy 90 ml nước cất cần thêm vào 10 ml dd HCl có pH = 3 để thu được 100 ml dd HCL có pH = 4
3) Ta có phản ứng trung hòa: H(+) + OH¯ --->H2O
___________________bđầu:10^¯5.V1__10^¯9
___________________p/ứ_:10^¯9.V2___10^¯... do H+ dư nên tính theo số mol OH¯)
____________sau p/ứ:10^¯5.V1 -10^¯9.V2__0
- Sau p/ư dd có pH = 8 => dư H(+)
-Số mol H+ dư = 10^¯5.V1 - 10^¯9.V2 ( mol)
-Thể tích dd sau p/ứ : V1 + V1 (lít )
-Nống độ H(+) sau p/ứ: 10^¯8(M)
-Ta có Cm = n / V <=> 10^¯8 = ( 10^¯5V1 - 10^¯V2) \ ( V1 + V2)
-Giải ra ta được 9,99.10^¯6V1 = 1,1.10^¯8 V2
=> V1 \ V2 = 1,1.10^¯8 \ 9,99.10^¯6 = 1.1( lần)