Cho kim loại sắt phản ứng vừa đủ vào 500ml dung dịch HCl. phản ứng thu được 6,7 lít khí H2(đktc).Biêt Fe=56;H=1;Cl=35,5 a.Viết phương trình phản ứng b.Tính khối lượng sắt tham gia phản ứng c.Tính nồng độ mol HCl đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(4.\)
\(n_{H_2}=\dfrac{3.36}{22.4}=0.15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.15.....0.3....................0.15\)
\(m_{Fe}=0.15\cdot56=8.4\left(g\right)\)
\(C_{M_{HCl}}=\dfrac{0.3}{0.5}=0.6\left(M\right)\)
\(5.\)
\(Đặt:n_{Fe}=a\left(mol\right),n_{Al}=b\left(mol\right)\)
\(m_{hh}=56a+27b=8.3\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Rightarrow a+1.5b=0.25\left(2\right)\)
\(\left(1\right),\left(2\right):a=b=0.1\)
\(\%Fe=\dfrac{5.6}{8.3}\cdot100\%=67.47\%\)
\(\%Al=32.53\%\)
bạn ơi cho mik hỏi: tại sao lại suy ra: a+1,5b=0,25 vậy ạ ? và cả bước tiếp theo nx ạ ?

Ta có: \(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
____0,1______0,2_____0,1____0,1 (mol)
a, \(C_{M_{HCl}}=\dfrac{0,2}{0,15}=\dfrac{4}{3}\left(M\right)\)
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, \(FeCl_2+2NaOH\rightarrow2NaCl+Fe\left(OH\right)_2\)
Theo PT: \(n_{NaOH}=2n_{FeCl_2}=0,2\left(mol\right)\)
\(\Rightarrow V_{NaOH}=\dfrac{0,2}{2}=0,1\left(l\right)\)

\(n_{H_2}=\dfrac{V}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:\(2Fe+6HCl\rightarrow2FeCl_3+3H_2\)
0,1 0,4 0,1 0,2
\(CM_{HCl}=\dfrac{n_{ct}}{V_{dd}}=\dfrac{0,4}{0,5}\)=0,8(M)

Câu 1
\(3Cl_2+2Fe\underrightarrow{t^o}2FeCl_3\)
\(n_{Cl_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(n_{Fe}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\) \(\Rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
Câu 2
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Gọi x và y lần lượt là số mol Fe và Mg
Bảo toàn e ta có \(2x+2y=2.0,25\) (1)
\(m_{hh}=56x+24y=10,16\left(g\right)\) (2)
Từ (1) và (2) => \(\left\{{}\begin{matrix}x=0,13\\y=0,12\end{matrix}\right.\)
a. \(\%m_{Fe}=\dfrac{0,13.56}{10,16}.100\%=71,65\%\)
\(\%m_{Mg}=100\%-71,65\%=28,35\%\)
b. Ta có \(n_{HCl}=n_{H^+}=2n_{H_2}=0,5\left(mol\right)\)
\(CM_{HCl}=\dfrac{0,5}{0,5}=1\left(M\right)\)

a)
$Fe + 2HCl \to FeCl_2 + H_2$
Theo PTHH :
$n_{Fe\ pư} = n_{H_2} = \dfrac{33,6}{22,4} = 1,5(mol)$
$m_{Fe\ pư} = 1,5.56 = 84(gam)$
b)
$n_{HCl} = 2n_{H_2} = 3(mol) \Rightarrow C_{M_{HCl}} = \dfrac{3}{0,5} = 6M$

12,1 gam (Fe, Zn) + HCl (vừa đủ) → muối FeCl 2 , ZnCl 2 + H 2

Đáp án là C

Đáp án B.
Số mol H2 là:
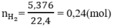
Số mol HCl nHCl = 0,5.1 = 0,5(mol)
2M + 2nHCl → 2MCln + nH2
Số mol HCl phản ứng: nHCl = 2. nH2 = 2.0,24 = 0,48(mol). So với ban đầu HCl phản ứng còn dư
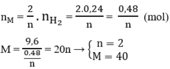
Vậy M là Ca

Câu 4:
Tính khối lượng của H2SO4 có trong dung dịch:
m = n x M x V
Trong đó:
n = 0,4 mol (số mol của H2SO4)
M = 98g/mol (khối lượng mol của H2SO4)
V = 200g (thể tích của dung dịch)
m = 0,4 mol x 98g/mol x 200g / 1000g = 7,84g
% = (khối lượng H2SO4 / khối lượng dung dịch) x 100 % = (7,84g / 200g) x 100 = 3,92% Vậy nồng độ % của dung dịch axít đã phản ứng là 3,92%.
C6
Mg + 2HCl -> MgCl2 + H2
m = n x M
n = m / M
Trong đó:
m = 9,6g (khối lượng của Mg)
M = 24,31g/mol (khối lượng mol của Mg)
n = 9,6g / 24,31g/mol = 0,395 mol
Mg + 2HCl -> MgCl2 + H2
Tỷ lệ phản ứng của Mg và HCl là 1:2, vì vậy số mol của HCl là 2 x 0,395 mol = 0,79 mol.
Để tính khối lượng của dung dịch sau phản ứng, ta cần biết khối lượng riêng của dung dịch HCl. Với dung dịch HCl có nồng độ 36,5%, khối lượng riêng xấp xỉ là 1,18 g/mL.
V = m / rho
V = 120g / 1,18 g/mL = 101,69 mL (thể tích của dung dịch)
m (HCl) = 0,79 mol x 36,5g/mol = 28,835 g (khối lượng của HCl sau phản ứng)
M (dung dịch sau phản ứng) = m + M(H2O) = 28,835g + 72g = 100,835g
% = (khối lượng chất tan / khối lượng dung dịch) x 100
% = (28,835g / 100,835g) x 100 = 28,62%
Vậy nồng độ phần trăm của dung dịch sau phản ứng là 28,62%.

