Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
- Acid hóa dung dịch sau khi thuỷ phân bằng dung dịch HNO3 để tránh trường hợp dư base, sinh ra kết tủa Ag2O:
AgNO3 + NaOH → AgOH + NaNO3
2AgOH → Ag2O + H2O
- Không thể thay dung dịch HNO3 bằng dung dịch H2SO4 hay HCl vì AgNO3 có thể phản ứng với H2SO4 hay HCl tạo kết tủa Ag2SO4 hay AgCl làm sai kết quả thí nghiệm.
AgNO3 + HCl → AgCl↓ + HNO3
2AgNO3 + H2SO4 → Ag2SO4↓+ 2HNO3

- Trong Thí nghiệm 1, chất lỏng xuất hiện ở đáy cốc không phải là benzene (benzene không màu).
- Vì benzene phản ứng với dung dịch nitric acid tạo nitrobenzene có màu vàng nhạt .
PTHH: C6H6 + HNO3 → C6H5NO2 + H2O

Thí nghiệm 1:
Khí sinh ra làm mất màu dung dịch bromine/thuốc tím.

CH2=CH2 + Br2 → CH2Br–CH2Br
3CH2=CH2 + 4H2O + 2KMnO4 → 3HO–CH2–CH2–OH + 2MnO2 + 2KOH

Giải thích:
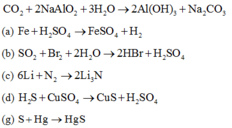
Các phản ứng oxi hóa – khử: (b), (c), (d), (g).
Đáp án C.

Đáp án: B
TN1:
CH2 = CH – CH2Cl + H2O → CH2 = CH – CH2OH + HCl
TN2:
CH2 = CH – CH2Cl + NaOH → CH2 = CH – CH2OH + NaCl
Cả hai dung dịch đều chứa ion Cl– nên đều tạo kết tủa trắng với AgNO3

a) Mục đích: Nhận biết ion Cl− trong dung dịch.
b) Acid hóa dung dịch sau khi thuỷ phân bằng dung dịch HNO3 để trung hòa NaOH dư.
Không thể thay dung dịch HNO3 bằng dung dịch H2SO4 hay HCI được vì khi cho dung dịch AgNO3 vào Ag+ sẽ kết hợp với SO42− và Cl− tạo kết tủa.