
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(\overline{M}=0,3125\cdot32=10\)
Theo sơ đồ đường chéo: \(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{10-2}{28-10}=\dfrac{4}{9}\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{N_2}=\dfrac{4}{4+9}\cdot100\%\approx30,77\%\\\%V_{H_2}=69,23\%\end{matrix}\right.\)


Ta có: \(n_{Mg}=\dfrac{3,96}{24}=0,165\left(mol\right)\)
BT e, có: 2nMg = 3nNO + 10nN2 = 0,33 (1)
Mà: \(d_{\left(NO,N_2\right)/H_2}=14,25\Rightarrow\dfrac{30n_{NO}+28n_{N_2}}{n_{NO}+n_{N_2}}=14,25.2\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{NO}=0,01\left(mol\right)\\n_{N_2}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow V=\left(0,01+0,03\right).22,4=0,896\left(l\right)\)

Đáp án A
![]()
Gọi
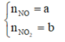
Có
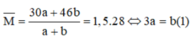
3Cu + 8HNO3 g 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 g Cu(NO3)2 + 2NO2 + 2H2O
Áp dụng định luật bảo toàn mol electron, ta có:

Vậy:
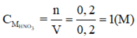
Nhận xét: Ngoài việc viết phản ứng để quan sát hệ số như trên, các bạn có thể ghi nhớ công thức cũng như hoàn toàn có thể suy luận ra công thức sau:
![]()

Đáp án A
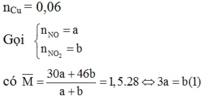
3Cu + 8HNO3 g 3Cu(NO3)2 + 2NO + 4H2O
Cu + 4HNO3 g Cu(NO3)2 + 2NO2 + 2H2O
Áp dụng định luật bảo toàn mol electron, ta có:

Nhận xét: Ngoài việc viết phản ứng để quan sát hệ số như trên, các bạn có thể ghi nhớ công thức cũng như hoàn toàn có thể suy luận ra công thức sau:
![]()

\(\overline{M_{bđ}}=15,2.2=30,4\)
\(n_{bđ}=\frac{1,12}{22,4}=0,5\left(mol\right)\)
\(\left\{{}\begin{matrix}n_{O2}:a\left(mol\right)\\n_{N2}:b\left(mol\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a+b=0,5\\\frac{32a+28b}{0,5}=30,4\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a=0,3\\b=0,2\end{matrix}\right.\)
\(\overline{M_{dư}}=30\)
\(n_{O2\left(dư\right)}=x\left(mol\right)\)
\(\Rightarrow\frac{32x+28.0,2}{x+0,2}=30\)
\(\Rightarrow x=0,2\)
\(n_{O2\left(pư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(4Y+O_2\rightarrow2Y_2O\)
0,4____0,1______
\(\Rightarrow M_Y=\frac{15,6}{0,4}=39\left(K\right)\)

Bạn kiểm tra lại đề bài thử nhé, không có hợp chất SO4 đâu, chỉ có ion SO42- thôi
d\(\frac{H_2}{N_2}\)= 2/28=1/14 <1
d\(\frac{NH_3}{N_2}\)= 17/28 < 1
d\(\frac{SO_3}{N_2}\)= 80/28 > 1.
d\(\frac{SO_2}{N_2}\)= 64/28 > 1.
d nhỏ kia là gì vậy em???