Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)Tại tđ cân bằng:
\(\left[N_2\right]=0,5-\dfrac{1}{2}.0,1=0,5-0,05=0,45\left(M\right)\)
\(\left[H_2\right]=0,6-\dfrac{3}{2}.0,1=0,6-0,15=0,45\left(M\right)\)
\(\Rightarrow k_c=\dfrac{\left[NH_3\right]^2}{\left[N_2\right].\left[H_2\right]^3}=\dfrac{0,1^2}{0,45.0,45^3}\approx0,244\)
b) Để tăng H tổng hợp \(NH_3\), chúng ta có thể:
- Tăng P bằng cách giảm V (chọn P phù hợp)
- Giảm nhiệt độ của hệ ( chọn nhiệt độ phù hợp)
- Thêm \(N_2;H_2\)

Chọn B
Theo giả thiết ta thấy ban đầu H 2 = N 2 = 1 M .
Thực hiện phản ứng tổng hợp NH3 đến thời điểm cân bằng NH 3 = 0 , 4 M
Phương trình phản ứng hoá học :

Theo (1) tại thời điểm cân bằng [NH3] = 0,8M; [H2] =0,4M; [NH3] = 0,4M.
Vậy hằng số cân bằng của phản ứng tổng hợp NH3 là :
K C = NH 3 2 N 2 H 2 3 = ( 0 , 4 ) 2 0 , 8. ( 0 , 4 ) 3 = 3 , 125

Đáp án B
Theo gải thiết ban đầu ta thấy [H2]=[N2]=1M
Thực hiện phản ứng tổng hợp NH3đến thời điểm cân bằng [NH3] = 0,4 m
Ta có: N2+3H2 ⇌2NH3
Bdau: 1………1………….0
p.ung:0,2…….0,6……….0,4
Sau: 0,8………0,4……….0,4
Tại thời điểm cân bằng [N2]=0,8;[H2]=0,4M;[NH3]=0,4M
→Kc = 3,125

Đáp án C
Lượng este lớn nhất thu được là lượng este ở trạng thái cân bằng.
Khi đó: n H 2 O = 2 3 ( m o l ) ; n C H 3 C O O H = n C 2 H 5 O H = 1 3 ( m o l )
⇒ K C = 2 3 . 2 3 1 3 . 1 3 = 4
Để hiệu suất đạt 80% (tính theo axit) khi tỉến hành este hóa 1 mol CH3COOH thì neste = 0,8(mol)
G ọ i n C 2 H 5 O H b a n đ ầ u = x ( m o l )
=> Ở trạng thái cân bằng n C 2 H 5 O H = x - 0 , 8 ( m o l ) ; n C H 3 C O O H = 0 , 2 ( m o l ) ; n H 2 O = 0 , 8 ( m o l )
⇒ K C = 0 , 8 . 0 , 8 0 , 2 ( x - 0 , 8 ) = 4 ⇒ x = 1 , 6 ( m o l )

N 2 (k) + 3 H 2 (k) ↔ 2 N H 3 (k)
Số mol khí ban đầu :
2 7 0
Số mol khí đã phản ứng :
x 3x
Số mol khí lúc cần bằng :
2 - x 7 - 3x 2x
Tổng số mol khí lúc cân bằng : (2 - x) + (7 - 3x) + 2x = 9 - 2x
Theo đề bài : 9 - 2x = 8,2 ⇔ x = 0,4
1. Phần trăm sô mol nitơ đã phản ứng: 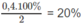
2. Thể tích (đktc) khí amoniac được tạo thành: 2.0,4.22,4 = 17,9 (lít).

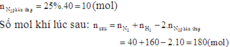
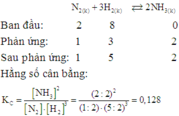
Gọi k1 là hằng số tốc độ của phản ứng thuận; k2 là hằng số tốc độ của phản ứng nghịch
\(CH_3COOH+C_3H_7OH⇌CH_3COOC_3H_7+H_2O\)
Ta có:
\(k_1=\dfrac{\left[CH_3COOC_3H_7\right]}{\left[CH_3COOH\right].\left[C_3H_7OH\right]};k_2=\dfrac{\left[CH_3COOH\right].\left[C_3H_7OH\right]}{\left[CH_3COOC_3H_7\right]}\)
Ở trạng thái cân bằng dung dịch chứa 1,4 - x (mol) CH3COOH; 1,4 - x (mol) C3H7OH và 0,6 + x (mol) CH3COOC3H7
\(\Rightarrow\dfrac{\left(0,6+x\right)}{\left(1,4-x\right).\left(1,4-x\right)}=2,25.\dfrac{\left(1,4-x\right)\left(1,4-x\right)}{0,6+x}\Rightarrow x\simeq0,53\)
Từ đó kết luận ở trạng thái cân bằng dung dịch chứa....