Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng mỗi phần là 4,8 gam.Phần 2 dùng nhiều axit hơn và thu được khối lượng chất rắn nhiều hơn nên phần 1 axit đã phản ứng hết.
Phần 1: nHCl=0,1x➞n\({H_2O}\)=0,05x
mrắn=\(4,8+36,5.0,1x-0,05x.18=8,1\)
➝x=1,2
Phần 2: n\(HCl\)=0,24(mol)
Nếu phần 2 HCl cũng hết thì n\({H_2O}\)=0,12(mol)
➞mrắn=\(4,8+0,24.36,5-0,12.18=11,4>9,2\) : vô lý➞axit còn dư
\(CuO+2HCl-->{CuCl_2}+{H_2O}\)
\(a\) \(a\)
\({Fe_2O_3}+6HCl-->{2FeCl_3}+{3H_2O}\)
b 2b
➝80a+160b=4,8
mrắn=135a+162,5.2b=9,2
➝a=b=0,02
%CuO=33,33%

PTHH:
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
0,15 0,15
\(CaO+2HCl\rightarrow CaCl_2+H_2O\)
Ta có: \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\Rightarrow m_{CaCO_3}=0,15\cdot100=15\left(g\right)\)
\(\Rightarrow m_{CaO}=20,6-15=5,6\left(g\right)\)
\(\Rightarrow\%m_{CaCO_3}=\dfrac{15\cdot100}{20,6}\approx73\%\)
\(\Rightarrow\%m_{CaO}=100\%-73\%=27\%\)

150ml = 0,15l
Số mol của kali hidroxit
CMKOH = \(\dfrac{n}{V}\Rightarrow n=C_M.V=0,2.0,15=0,03\left(mol\right)\)
Pt : K2O + H2O \(\rightarrow\) 2KOH\(|\)
1 1 2
0,015 0,03
a) Số mol của kali oxit
nK2O = \(\dfrac{0,03.1}{2}=0,015\left(mol\right)\)
Khối lượng của kali oxit
mK2O= nK2O . MK2O
= 0,015 . 94
= 1,41 (g)
Khối lượng của đồng (II) oxit
mCuO = 13 - 1,41
= 11,59 (g)
b) 0/0K2O = \(\dfrac{m_{K2O}.100}{m_{hh}}=\dfrac{1,41.100}{13}=10,85\)0/0
0/0CuO = \(\dfrac{m_{CuO}.100}{m_{hh}}=\dfrac{11,59.100}{13}=89,15\)0/0
c) Có : mCuO = 11,59 (g)
số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{11,59}{80}=0,14\left(mol\right)\)
Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,14 0,14
K2O + H2SO4 → K2SO4 + H2O\(|\)
1 1 1 1
0,015 0,015
Số mol tổng của axit sunfuric
nH2SO4 = 0,14 + 0,015
= 0,155 (mol)
Khối lượng của axit sunfuric
mH2SO4 = nH2SO4 . MH2SO4
= 0,155 . 98
= 15,19 (g)
Khối lượng của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{dd}=\dfrac{m_{ct}.100}{C}=\dfrac{15,19.100}{20}=\) 75,95 (g)
Thể tich của dung dịch axit sunfuric cần dùng
D = \(\dfrac{m}{V}\Rightarrow V=\dfrac{m}{D}=\dfrac{75,95}{1,143}=66,45\left(ml\right)\)
Chúc bạn học tốt

Gọi số mol của BaO, BaCO3, NaHCO3 trong 30,19g hh lần lượt là x, y, z
Có 153x + 197y + 84z = 30,19
Phần 1:
BaO + H2O → Ba(OH)2
x x
OH- + HCO3- → CO32- + H2O
Ba2+ + CO32- → BaCO3
n kết tủa = 0,11
Phần 2:
BaCO3 →BaO + CO2
y y
2NaHCO3 → Na2CO3 + H2O + CO2
z z/2 z/2
=> mCO2 + mH2O = 30,19 – 26,13 = 4,06
=> 44 (y + z/2) + 18 . z/2= 4,06
TH1: Ba tạo kết tủa hoàn toàn thành BaCO3 và NaHCO3 dư
=> nBaCO3 = nBaCO3 + nBaO = 0,11 => Không thỏa mãn
TH2: Ba(OH)2 dư và NaHCO3 hết
=> x + y = 0,11 và y + z = 0,11
=> x = 0,1; y = 0,05 và z = 0,06
a.
hh Y gồm BaO: 0,15 mol; Na2CO3: 0,03 mol
BaO + H2O → Ba(OH)2
0,15 0,15
Ba(OH)2 + Na2CO3 → BaCO3 + 2NaOH
0,15 0,03 0,03 0,06
=> m kết tủa = 0,03 . 197 = 5,91g
m dd = m chất rắn + mH2O – mBaCO3 = 26,13 + 79,78 – 5,91 = 100
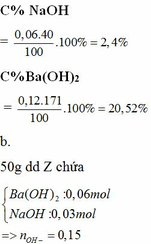
nAl2(SO4)3 = 0,02 => nAl3+ = 0,04; nSO42- = 0,06
Ba2+ + SO42- → BaSO4
0,06 0,06 0,06
nAl(OH)3 = 0,01 => mAl(OH)3 = 0,78g
m = 0,78 + 0,06 . 233 = 14,76g






