
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Hiện nay, một số bạn học sinh đang chạy theo những “mốt” quần áo rất đắt tiền nhưng có hình dáng rất “kì dị”. Các bạn cho rằng như vậy là hợp thời nhưng các bạn đâu có nhận ra là rnình phai nhạt đi nét truyền thống văn hóa của dân tộc Việt Nam ta. Vậy thì việc chạy theo mốt như vậy có đúng hay không?
Các bạn đang trút bỏ chiếc áo sơ mi trắng, chiếc quần xanh đen để mặc vào mình những bộ quần áo không hợp với người Việt Nam chúng ta. Hôm nay là mốt quần bò tua gấu..., ngày mai lại là “mốt” áo ngắn cùn cỡn, giày cao gót, ngày kia là áo chun, áo thụng rồi tiếp đến không biết còn những “mốt” nào được tung ra thị trường nữa. Các bạn cứ vòi tiền bố mẹ, đòi mua những thứ quần áo như vậy thì không biết phải cần đến bao nhiêu tiền? Mồ hôi công sức bố mẹ làm ra được “đốt” dưới bàn tay của các bạn đấy.
Có những bạn ngày trước vốn ăn mặc rất giản dị nhưng chỉ sau một thời gian cách ăn mặc đã thay đổi: tóc tém với đôi đường vàng đỏ, áo xanh quần túm thủng gối, ngắn thì thủng tay. Các bạn cho rằng mình phải án mặc như vậy mới là người “sành điệu”, cho khỏi bị các bạn chê là “lỗi thời”, “lạc hậu”. Nhưng các bạn ơi, xin các bạn hãy quay nhìn theo một hướng khác, hướng đến các bạn vẫn mặc theo lối truyền thống với bộ đồng phục quen thuộc, chắc chắn các bạn sẽ nhận ra nhiều điều.
Trong khi các bạn đang theo đuổi các “mốt” thời trang thì có những bạn vẫn mặc những bộ quần áo được các bạn cho là “lỗi thời”, “lạc hậu”, nhưng các bạn ấy vẫn được mọi người tôn trọng vì bộ quần áo ấy lại rất hợp với tuổi trẻ, vẫn rất đẹp, rất hấp dẫn. Vậy phải chăng cứ phải mặc theo lối “sành điệu” mới được coi là đẹp sao? Không, các bạn thấy đấy, với cách ăn mặc giản dị, phù hợp với lứa tuổi học sinh, các bạn ấy vẫn đẹp, đẹp một cách ngây thơ, hồn nhiên, trong sáng. Từ đó có thể khẳng định rằng: Đẹp không cần cứ phải “mốt”.
Hơn thế, hiện nay nước ta có rất nhiều khách du lịch đến, nếu họ thấy trên đường phốtoàn là những thanh niên học sinh với những bộ quần áo “sành điệu” như vậy liệu họ nghĩ gì về trang phục của nước ta, về truyền thông văn hóa Việt Nam?
Chính vì những lí do trên mà cách ăn mặc của một số bạn hiện nay không được chấp nhận và cũng vì vậy tôi hi vọng các bạn sẽ thay đổi cách ăn mặc của mình sao cho hợp thời nhưng phù hợp với hoàn cảnh, truyền thông đất nước ta và phù hợp với tính cách của bản thân từng bạn, những đội viên và những đoàn viên Đoàn Thanh niên Cộng sản Hồ Chí Minh.

BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Sơ lược về sự phát minh ra bảng tuần hoàn: Thời Trung cổ, loài người đã biết các nguyên tố vàng, bạc, đồng, chì, sắt, thuỷ ngân và lưu huỳnh. Năm 1649, loài người tìm ra nguyên tố photpho. Đến năm 1869, mới có 63 nguyên tố được tìm ra. Năm 1817, Đô-be-rai-nơ (J.Dobereiner) nhận thấy khối lượng nguyên tử của stronti ở giữa khối lượng nguyên tử của hai nguyên tố bari và canxi. Bộ ba nguyên tố đầu tiên này có tính chất tương tự nhau. Tiếp theo, các nhà khoa học đã tìm ra các bộ ba khác có quy luật tương tự.
Năm 1862, nhà địa chất Pháp Đờ Săng - cuốc - toa (De Chancourtoi) đã sắp xếp các nguyên tố hoá học theo chiều tăng của khối lượng nguyên tử lên một băng giấy (băng giấy này được cuốn quanh hình trụ theo hình lò xo xoắn). Ông nhận thấy tính chất của các nguyên tố giống như tính chất của các con số, tính chất đó lặp lại sau mỗi 7 nguyên tố.
Năm 1864, Giôn Niu-lan (John Newlands), nhà hoá học Anh, đã tìm ra quy luật: Mỗi nguyên tố hoá học đều thể hiện tính chất tương tự như nguyên tố thứ 8 khi xếp các nguyên tố theo khối lượng nguyên tử tăng dần.
Năm 1860, nhà bác học người Nga Men-đê-lê-ép đã đề xuất ý tưởng xây dựng bảng tuần hoàn các nguyên tố hoá học. Năm 1869, ông công bố bản "bảng tuần hoàn các nguyên tố hoá học" đầu tiên. Năm 1870, nhà khoa học người Đức Lô-tha Mây-ơ (Lothar Mayer) nghiên cứu độc lập cũng đã đưa ra một bảng tuần hoàn các nguyên tố hoá học tương tự như bảng của Men-đê-lê-ép.
I. NGUYÊN TẮC SẮP XẾP CÁC NGUYÊN TỐ TRONG BẢNG TUẦN HOÀN
Ngày nay, dưới ánh sáng của thuyết cấu tạo nguyên tử, các nguyên tố hoá học được sắp xếp trong bảng tuần hoàn theo các nguyên tắc:
1. Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
2. Các nguyên tố có cùng số lớp electron trong nguyên tử được sắp thành một hàng.
3. Các nguyên tố có cùng số electron hoá trị(1) trong nguyên tử trên được gọi là bảng tuần hoàn các nguyên tố hoá học (gọi tắt là bảng tuần hoàn).
Click ở đây để xem minh họa bảng tuần hoàn
II. CẤU TẠO CỦA BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
1. Ô nguyên tố
Mỗi nguyên tố hoá học được xếp vào một ô của hàng, gọi là ô nguyên tố. Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó.
Thí dụ: (Al) chiếm ô 13 trong bảng tuần hoàn, vậy số hiệu nguyên tử của nguyên tố Al là 13, số đối với điện tích hạt nhân là 13, hạt nhân có 13 proton và vỏ nguyên tử của Al có 13 electron.
2. Chu kì
Chu kì dãy các nguyên tố mà nguyên tử của chúng có cùng số electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Chu kì thường bắt đầu bằng một kim loại kiềm và kết thúc bằng một khí hiếm (trừ chu kì 1 và chu kì 7).
Bảng tuần hoàn gồm 7 chu kì. Các chu kì được đánh số từ 1 đến 7.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử.
Chu kì 1 gồm 2 nguyên tố là H (Z = 1), 1s1 và He (Z = 2), 1s2.
Nguyên tử của hai nguyên tố này chỉ có 1 lớp electron, đó là lớp K.
Chu kì 2 gồm 8 nguyên tố, bắt đầu là Li (Z = 3), 1s22s1 và kết thúc là Ne (Z = 10), 1s22s22p6.
Nguyên tử của các nguyên tố này có 2 lớp electron: lớp K (gồm 2 electron) và lớp L. Số electron của lớp L tăng dần từ 1 ở liti đến tối đa là 8 ở neon (lớp electron ngoài cùng bão hoà).
Chu kì 3 gồm 8 nguyên tố, bắt đầu từ Na (Z = 11), 1s22s22p63s1 và kết thúc là Ar (Z = 18), 1s22s22p63s23p6. Nguyên tử của các nguyên tố này có 3 lớp electron: lớp K (2 electron), lớp L (8 electron) và lớp M (8 electron). Số electron của lớp M tăng dần từ 1 ở natri đến tối đa là 8 ở agon (lớp electron ngoài cùng bền vững). Bảng dưới đây cho biết số electron ở lớp ngoài cùng của nguyên tử các nguyên tố thuộc chu kì 2 và 3.
Chu kì 2 | Li | Be | B | C | N | O | F | Ne |
Chu kì 3 | Na | Mg | Al | Si | P | S | Cl | Ar |
Số electron ở lớp ngoài cùng | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
Chu kì 4 và chu kì 5: Mỗi chu kì đều có 18 nguyên tố, bắt đầu là một kim loại kiềm (K (Z = 19): [Ar]4s1 và Rb (Z = 37): [Kr]5s1), kết thúc là một khí hiếm (Kr (Z = 36): [Ar]3d104s24p6 và Xe (Z = 54): [Kr]4d105s25p6).
Chu kì 6: Có 32 nguyên tố, bắt đầu từ kim loại kiềm Cs (Z = 55), [Xe]6s1 và kết thúc là khí hiếm Rn (Z = 86), [Xe]4f145d106s26p6.
Chu kì 7: Chưa hoàn thành (Chu kỳ dở dang).
Các chu kì 1, 2, 3 được gọi là các chu kì nhỏ.
Các chu kì 4, 5, 6, 7 được gọi là các chu kì lớn.
14 nguyên tố đứng sau La (Z = 57) thuộc chu kì 6 (được gọi là các nguyên tố thuộc họ lantan) và 14 nguyên tố sau Ac (Z = 89) thuộc chu kì 7 (gọi là các nguyên tố họ actini) có cấu hình electron đặc biệt, được xếp thành hai hàng ở phần cuối bảng. Như vậy, nếu trừ 14 nguyên tố trên, chu kì 6 cũng còn 18 nguyên tố như các chu kì 4 và 5, chu kì 7 còn 10 nguyên tố.
3. Nhóm nguyên tố
Nhóm nguyên tố là tập hợp các nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hoá học gần giống nhau và được xếp thành một cột.
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A đánh số từ IA đến VIIIA và 8 nhóm B đánh số từ IIIB đến VIIIB, rồi IB và IIB theo chiều từ trái sang phải trong bảng tuần hoàn (xem Bảng tuần hoàn). Mỗi nhóm là một cột, riêng nhóm VIIIB gồm 3 cột.
Nguyên tử các nguyên tố trong cùng một nhóm có số electron hoá trị bằng nhau và bằng số thứ tự của nhóm (trừ hai cột cuối của nhóm VIIIB).
Ngoài cách chia các nguyên tố người ta còn chia chúng thành các khối như sau:
Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA (được gọi là nhóm kim loại kiềm) và nhóm IIA (được gọi là nhóm kim loại kiềm thổ). Thí dụ:
Na (Z = 11): 1s22s22p63s1; Mg (Z = 12): 1s22s22p63s2;
Các nguyên tố s hoạt động hoá học rất mạnh, còn được gọi là các kim loại hoạt động. Chúng có khối lượng riêng nhỏ, nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn hầu hết các kim loại khác.
Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ He).
Thí dụ:
O (Z = 8): 1s22s22p4; Ne (Z = 10): 1s22s22p6;
Nhóm A bao gồm các nguyên tố s và nguyên tố p.
Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B.
Khối nguyên tố f gồm các nguyên tố xếp ở hai hàng cuối bảng.
Nhóm B bao gồm các nguyên tố d và nguyên tố f.
Tư liệu
ĐÔI NÉT VỀ ĐI-MI-TRI-VA-NO-VÍCH MEN-ĐÊ-LÊ-ÉP
VÀ ĐỊNH LUẬT TUẦN HOÀN - BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ HOÁ HỌC
Đi-mi-tri I-va-no-vích Men-đê-lê-ép sinh ngày 27 tháng 1 năm 1934 ở thành phố To-bon (Tobonxk), trong một gia đình có 17 người con, bố là hiệu trưởng trường trung học To-bon. Sau khi tốt nghiệp Trường Trung học To-bon, ông vào học tại Trường Đại học Sư phạm Pê-téc-bua và năm 1855, khi tốt nghiệp, ông đã được nhận huy chương vàng. Trong hai năm 1859, 1860 Men-đê-lê-ép làm việc ở Đức. Sau đó, ông trở về nước Nga và được bổ nhiệm là giáo sư của Trường Đại học Kĩ thuật Pe-téc-bua. Hai năm sau, ông được bổ nhiệm là giáo sư của Trường Đại học Tổng hợp Pê-téc-bua. Sau 33 năm nghiên cứu khoa học và giảng dạy, năm 1892 Men-đê-lê-ép được bổ nhiệm làm giám đốc khoa học bảo tồn của Trạm Cân đo mẫu. Năm 1893, trạm này đổi thành Viện Nghiên cứu khoa học đo lường mang tên Men-đê-lê-ép.
Kết quả hoạt động sáng tạo vĩ đại nhất của Men-đê-lê-ép là sự phát minh ra định luật tuần hoàn các nguyên tố năm 1869, lúc đó ông mới 35 tuổi. Ngoài ra, ông còn có nhiều công trình khác có giá trị như: các nghiên cứu về trọng lượng riêng của dung dịch nước, dung dịch của rượu - nước và khái niệm về dung dịch. Những công trình nghiên cứu của Men-đê-lê-ép về dung dịch và phần quan trọng của thuyết dung dịch hiện đại.
Cuốn "Cơ sở hoá học" là công trình xuất sắc của Men-đê-lê-ép, trong đó lần đầu tiên toàn bộ hoá học vô cơ được trình bày theo quan điểm của định luật tuần hoàn. Cuốn sách đã được tái bản rất nhiều lần.
Kết hợp một cách chặt chẽ lí thuyết với thực tế, Men-đê-lê-ép luôn luôn quan tâm đến sự phát triển công nghiệp của đất nước Nga.
Bảng tuần hoàn các nguyên tố có ảnh hưởng lớn đến sự phát triển của hoá học. Nó không những là sự phân loại tự nhiên đầu tiên các nguyên tố hoá học, cho biết các nguyên tố có mối liên hệ chặt chẽ và hệ thống, mà còn định hướng cho việc nghiên cứu tiếp tục các nguyên tố mới.
Ngày nay, định luật tuần hoàn vẫn còn là sợi chỉ dẫn đường và là lí thuyết chủ đạo của hoá học. Trên cơ sở đó, trong những năm gần đây các nguyên tố sau urani đã được điều chế nhân tạo và được xếp sau urani trong bảng tuần hoàn. Một trong các nguyên tố đó là nguyên tố 101 đã được điều chế lần đầu tiên năm 1955 và được đặt tên là mendelevi để tỏ lòng kính trọng nhà bác học Nga vĩ đại.
Việc phát minh ra định luật tuần hoàn và bảng tuần hoàn các nguyên tố hoá học có giá trị to lớn không những đối với hoá học, mà cả đối với triết học.
Thuyết cấu tạo nguyên tử ở thế kỷ XX đã soi sáng vào định luật tuần hoàn và bảng tuần hoàn các nguyên tố, tìm ra nhiều điều mới mẻ sâu sắc hơn. Những lời tiên tri của Men-đê-lê-ép "Định luật tuần hoàn sẽ không bị đe doạ phá vỡ, mà chỉ có sự bổ sung và phát triển" đã có những bằng chứng tuyệt vời.
Bài 8:
SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ HOÁ HỌC
I. SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ
Bảng dưới đây cho biết cấu hình electron ngoài cùng của nguyên tử các nguyên tố nhóm A.
Bảng 5. Cấu hình electron lớp ngoài cùng của nguyên tử
các nguyên tố nhóm A
Nhóm Chu kì | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA |
1 | H 1s1 | He 1s2 | ||||||
2 | Li 2s1 | Be 2s2 | B 2s22p1 | C 2s22p2 | N 2s22p3 | O 2s22p4 | F 2s22p5 | Ne 2s22p6 |
3 | Na 3s1 | Mg 3s2 | Al 3s23p1 | Si 3s23p2 | P 3s23p3 | S 3s23p4 | Cl 3s23p5 | Ar 3s23p6 |
4 | K 4s1 | Ca 4s2 | Ga 4s24p1 | Ge 4s24p2 | As 4s24p3 | Se 4s24p4 | Br 4s24p5 | Kr 4s24p6 |
5 | Rb 5s1 | Sr 5s2 | In 5s25p1 | Sn 5s25p2 | Sb 5s25p3 | Te 5s25p4 | I 5s25p5 | Xe 5s25p6 |
6 | Cs 6s1 | Ba 6s2 | Ti 6s26p1 | Pb 6s26p2 | Bi 6s26p3 | Po 6s26p4 | At 6s26p5 | Rn 6s26p6 |
7 | Fr 7s1 | Ra 7s2 |
|
Xét cấu hình electron nguyên tử của các nguyên tố trong bảng 5 ta thấy: Đầu mỗi chu kỳ là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns1. Kết thúc mỗi chu kỳ là nguyên tố có cấu hình electron lớp ngoài cùng của nguyên tử là ns2np6 (trừ chu kỳ 1). Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố trong cùng một nhóm A được lặp đi lặp lại sau mỗi chu kỳ, ta nói rằng: chúng biến đổi một cách tuần hoàn.
Như thế, sự biến đổi tuần hoàn về cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố khi điện tích hạt nhân tăng dần chính là nguyên nhân của sự biến đổi tuần hoàn tính chất của các nguyên tố.
II- CẤU HÌNH ELECTRON NGUYÊN TỬ CỦA CÁC NGUYÊN TỐ NHÓM A
1. Cấu hình electron nguyên tử của các nguyên tố nhóm A
a) Nguyên tử các nguyên tố trong cùng một nhóm A có cùng số electron lớp ngoài cùng. Chính sự giống nhau về cấu hình electron lớp ngoài cùng của nguyên tử là nguyên nhân của sự giống nhau về tính chất hoá học của các nguyên tố trong cùng một nhóm A.
b) Số thứ tự của nhóm (IA, IIA...) có biết số electron lớp ngoài cùng và đồng thời cũng là số electron hoá trị trong nguyên tử các nguyên tố đó.
c) Các electron hoá trị của các nguyên tố thuộc hai nhóm IA, IIA là electron s, các nguyên tố đó là các nguyên tố s. Các electron hoá trị của các nguyên tố thuộc sáu nhóm A tiếp theo là các electron s và p, các nguyên tố đó là các nguyên tố p (trừ He).
2. Một số nhóm A tiêu biểu
a) Nhóm VIIIA là nhóm khí hiếm, gồm các nguyên tố : heli, neon, agon, kripton, xenon và rađon.
Nguyên tử của các nguyên tố trong nhóm (trừ heli) đều có 8 lớp electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns2np6). Đó là cấu hình electron bền vững.
Hầu hết các khí hiếm đều không tham gia các phản ứng hoá học (trừ một số trường hợp đặc biệt). Ở điều kiện thường, các khí hiếm đều ở trạng thái và phân tử chỉ gồm một nguyên tử.
b) Nhóm IA là nhóm kim loại kiềm gồm các nguyên tố: liti, natri, kali, rubiđi, xesi (ngoài ra còn có nguyên tố phóng xạ franxi).
Nguyên tử của các nguyên tố kim loại kiềm chỉ có 1 electron ở lớp ngoài cùng (cấu hình electron lớp ngoài cùng là ns1). Vì vậy, trong các phản ứng hoá học, nguyên tử của các nguyên tố kim loại kiềm có khuynh hướng nhường đi 1 electron để đạt đến cấu hình electron bền vững của khí hiếm. Do đó, trong các hợp chất, các nguyên tố kim loại kiềm chỉ có hoá trị 1.
Các kim loại kiềm là những kim loại điển hình, thường có những phản ứng sau:
- Tác dụng mạnh với oxi tạo thành oxit bazơ tan trong nước, thí dụ Li2O, Na2O,...
- Tác dụng mạnh với nước ở nhiệt độ thường tạo thành hiđro và hiđroxit kiềm mạnh, thí dụ NaOH, KOH,...
- Tác dụng với các phi kim khác tạo thành muối, thí dụ NaCl, K2S,...
c) Nhóm VIIA là nhóm halogen, gồm các nguyên tố: flo, clo, brom, iot (ngoài ra còn có nguyên tố phóng xạ atatin).
Nguyên tử của các nguyên tố halogen có 7 electron ở lớp ngoài cùng (cấu hình electron ở lớp ngoài cùng là ns2np5). Vì vậy, trong các phản ứng hoá học các nguyên tử hlogen có khuynh hướng thu thêm 1 electron để đạt đến cấu hình electron bền vững của khí hiếm (trừ At). Do đó, trong các hợp chất nguyên tố kim loại, các nguyên tố halogen có hoá trị 1.
Ở dạng đơn chất, các phân tử halogen gồm hai nguyên tử: F2, Cl2, Br2, I2. Đó là những phi kim điển hình, thường có những phản ứng sau:
- Tác dụng với kim loại cho các muối như KBr, AlCl3...
- Tác dụng với hiđro tạo ra những hợp chất khí HF; HCl; HBr; HI; trong nước chúng là những dung dịch axit.
- Hiđroxit của các halogen là những axit, thí dụ : HClO, HClO3.
Bài 9:
SỰ BIẾN ĐỔI TUẦN HOÀN TÍNH CHẤT CỦA CÁC
NGUYÊN TỐ HOÁ HỌC. ĐỊNH LUẬT TUẦN HOÀN
I - TÍNH KIM LOẠI, TÍNH PHI KIM
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ mất electron để trở thành ion dương. Nguyên tử càng dễ mất electron, tính kim loại của nguyên tố càng mạnh.
Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ thu electron để trở thành ion âm. Nguyên tử càng dễ thu electron thì tính phi kim của nguyên tố càng mạnh.
Ranh giới tương đối giữa nguyên tố kim loại, phi kim trong bảng tuần hoàn các nguyên tố hoá học (trang 37) được phân cách bằng đường dích dắc in đậm. Phía phải là các nguyên tố phi kim, phía trái là các nguyên tố kim loại.
1. Sự biến đổi tính chất trong một chu kỳ
Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân, tính kim loại của các nguyên tố yếu dần, đồng thời tính phi kim mạnh dần.
Thí dụ: Chu kỳ bắt đầu từ nguyên tố Na (Z = 11), [Ne]3s1, là một kim loại điển hình. Rồi lần lượt đến Mg (Z = 12), [Ne]3s2, là kim loại mạnh nhưng hoạt động kém natri. Al (Z = 13), [Ne]3s23p1, là một kim loại nhưng hiđroxit đã có tính chất lưỡng tính. Si (Z = 14), [Ne]3s23p2 là một phi kim. Từ P (Z = 15), [Ne]3s23p3 đến S (Z = 16), [Ne]3s23p4 tính phi kim mạnh dần. Cl (Z = 17), [Ne]3s23p5 là một phi kim điển hình, rồi đến khí hiếm Ar (Z = 18), [Ne]3s23p6. Quy luật trên được lặp lại đối với mỗi chu kỳ.
Có thể giải thích quy luật biến đổi tính chất trên theo bán kính nguyên tử:
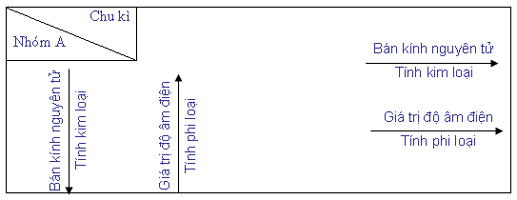
Trong một chu kỳ, khi đi từ trái sang phải, điện tích hạt nhân tăng dần nhưng số lớp electron của nguyên tử các nguyên tố bằng nhau, do đó lực hút của hạt nhân với các electron lớp ngoài cùng tăng lên làm cho bán kính nguyên tử giảm dần (xem hình 2.1), nên khả năng dễ nhường electron (đặc trưng cho tính kim loại của nguyên tố) giảm dần, đồng thời khả năng thu electron (đặc trưng cho tính phi kim của nguyên tố) tăng dần.

Hình 2.1. Bán kính nguyên tử của một số nguyên tố (nm)
Trong mỗi chu kỳ, bán ính nguyên tử giảm từ trái qua phải.
Trong mỗi nhóm A, bán kính nguyên tử tăng theo chiều từ trên xuống dưới
2. Sự biến đổi tính chất trong một nhóm A
Trong một nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại của các nguyên tố mạnh dần, đồng thời tính phi kim yếu dần.
Thí dụ:
Nhóm IA gồm các kim loại điển hình: Tính chất kim loại tăng rõ rệt từ Li (Z = 3), 1s22s1 đến Cs (Z = 55), [Xe]6s1 tức là khả năng mất electron tăng dần. Xesi là nguyên tố kim loại mạnh nhất.
Nhóm VIIA gồm các kim loại điển hình: Tính phi kim giảm dần từ F (Z = 9), 1s22s22p5 đến I (Z = 53), [Kr] 4d105s25p5, tức là khả năng thu thêm electron giảm dần. Flo là nguyên tố phi kim mạnh nhất.
Quy luật đó được lặp lại đối với các nhóm A khác và được giải thích như sau: Trong một nhóm A, theo chiều từ trên xuống dưới, điện tích hạt nhân tăng, nhưng đồng thời số lớp electron cũng tăng làm bán kính nguyên tố tăng nhanh và chiếm ưu thế hơn nên khả năng nhường electron của các nguyên tố càng tăng lên - tính kim loại tăng và khả năng nhận electron của các nguyên tố giảm - tính phi kim giảm.
Nguyên tử Cs có bán kính nguyên tử lớn nhất nên dễ nhường electron hơn cả, nó là kim loại mạnh nhất. Nguyên tử F có bán kính nguyên tử nhỏ nhất nên dễ thu thêm electron hơn cả, nó là phi kim mạnh nhất.
3. Độ âm điện
a) Khái niệm
Độ âm điện của một nguyên tử đặc trưng cho khả năng hút electron của nguyên tử đó khi hình thành liên kết hoá học.
Như vậy, độ âm điện của nguyên tử càng lớn thì tính phi kim của nó càng mạnh. Ngược lại, độ âm điện của nguyên tử càng nhỏ thì tính kim loại của nó càng mạnh.
b) Bảng độ âm điện
Trong hoá học, có nhiều thang độ âm điện khác nhau do các tác giả tính toán trên những cơ sở khác nhau. Dưới đây giới thiệu bảng giá trị độ âm điện do nhà hoá học Pau-linh (Pauling) thiết lập năm 1932. Vì nguyên tố flo là phi kim mạnh nhất, Pau-linh quy ước lấy độ âm điện của nó để xác định độ âm điện tương đối của các nguyên tử nguyên tố khác.

Hình 2.2. Nhà hoá học người Mĩ Pau-linh (L.C. Pauling, 1901 - 1994)
Giải thưởng No-ben Hoá học năm 1954, giải thưởng No-ben Hoà bình năm 1962
Bảng 6. Giá trị độ âm điện của nguyên tử một số nguyên tố nhóm A
theo Pau-linh
Nhóm Chu kì | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
1 | H 2,20 | ||||||
2 | Li 0,98 | Be 1,57 | B 2,04 | C 2,55 | N 3,04 | O 3,44 | F 3,98 |
3 | Na 0,93 | Mg 1,31 | Al 1,61 | Si 1,90 | P 2,19 | S 2,58 | Cl 3,16 |
4 | K 0,82 | Ca 1,00 | Ga 1,81 | Ge 2,01 | As 2,18 | Se 2,55 | Br 2,96 |
5 | Rb 0,82 | Sr 0,95 | In 1,78 | Sn 1,96 | Sb 2,05 | Te 2,1 | I 2,66 |
6 | Cs 0,79 | Ba 0,89 | T1 1,62 | Pb 2,33 | Bi 2,02 | Po 2,0 | At 2,2 |
Trong một chu kỳ, khi đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung tăng dần.
Trong một nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân, giá trị độ âm điện của các nguyên tử nói chung giảm dần.
Quy luật biến đổi độ âm điện phù hợp với sự biến đổi tính kim loại, tính phi kim của các nguyên tố trong một chu kỳ và trong một nhóm A mà ta đã xét ở trên.
Kết luận: Tính kim loại, tính phi kim của các nguyên tố biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân.
II - HOÁ TRỊ CỦA CÁC NGUYÊN TỐ
Trong một chu kỳ, đi từ trái sang phải, hoá trị cao nhất của các nguyên tố trong hợp chất với oxi tăng lần lượt từ 1 đến 7, còn hoá trị của các phi kim trong hợp chất với hiđro giảm từ 4 đến 1.
Thí dụ: trong chu kỳ 3, ba nguyên tố đầu chu kỳ (Na, Mg, Al) tạo thành hợp chất oxit, trong đó chúng có hoá trị lần lượt là 1, 2, 3. Các nguyên tố tiếp theo (Si, P, S, Cl) có hoá trị lần lượt là 4, 5, 6,7 trong oxit cao nhất.
Các nguyên tố phi kim Si, P, S, Cl tạo được hợp chất với hiđro, trong đó chúng có hoá trị lần lượt 4, 3, 2,1.
Đối với các chu kỳ khác, sự biến đổi hoá trị của các nguyên tố cũng diễn ra tương tự (xem trang 7).
Bảng 7. Sự biến đổi tuần hoàn hoá trị của các nguyên tố
Số thứ tự nhóm A | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
Hợp chất với oxi | Na2O K2O | MgO CaO | Al2O3 Ga2O3 | SiO2 GeO2 | P2O5 As2O5 | SO3 SeO3 | Cl2O7 Br2O7 |
Hoá trị cao nhất với oxi | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
Hợp chất khí với hiđro | SiH4 GeH4 | PH3 AsH3 | H2S H2Se | HCl HBr | |||
Hoá trị với hiđro | 4 | 3 | 2 | 1 |
II - OXIT VÀ HIĐROXIT CỦA CÁC NGUYÊN TỐ NHÓM A
Trong một chu kỳ, đi từ trái sang phải theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần.
Bảng 8. Sự biến đổi tính axit - bazơ
Na2O Oxit bazơ | MgO Oxit bazơ | Al2O3 Oxit lưỡng tính | SiO2 Oxit axit | P2O5 Oxit axit | SO3 Oxit axit | Cl2O7 Oxit axit |
NaOH Bazơ mạnh (kiềm) | Mg(OH)2 Bazơ yếu | Al(OH)3 Hiđroxit lưỡng tính | H2SiO3 Axit yếu | H3PO4 Axit trung bình | H2SO4 Axit mạnh | HClO4 Axit rất mạnh |
Tính bazơ yếu dần đồng thời tính axit mạnh dần
Sự biến đổi tính chất như thế được lặp lại ở các chu kỳ sau.
IV - ĐỊNH LUẬT TUẦN HOÀN
Trên cơ sở khảo sát sự biến đổi tuần hoàn của cấu hình electron nguyên tử, bán kính nguyên tử, độ âm điện của nguyên tử, tính kim loại và tính phi kim của các nguyên tố hoá học, thành phần và tính chất các hợp chất của chúng, ta thấy tính chất của các nguyên tố hoá học biến đổi theo chiều điện tích hạt nhân tăng, nhưng không liên tục mà tuần hoàn.
Định luật tuần hoàn về các nguyên tố hoá học được phát biểu như sau:
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Bài 10:
Ý NGHĨA CỦA BẢNG TUẦN HOÀN
CÁC NGUYÊN TỐ HOÁ HỌC
I - QUAN HỆ GIỮA VỊ TRÍ CỦA NGUYÊN TỐ VÀ CẤU TẠO NGUYÊN TỬ CỦA NÓ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại (xem sơ đồ sau):
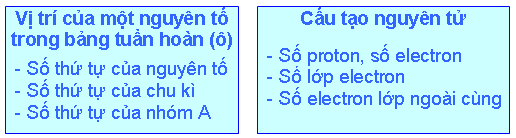
Thí dụ 1: Biết nguyên tố có số thứ tự là 19 thuộc chu kỳ 4, nhóm IA, có thể suy ra:
Nguyên tử của nguyên tố đó có 19 proton, 19 electron.
Nguyên tử đó có 4 lớp electron (vì số lớp electron bằng số thứ tự của chu kì).
Có 1 electron ở lớp ngoài cùng (vì số electron lớp ngoài cùng bằng số thứ tự của nhóm A). Đó là nguyên tố kali.
Thí dụ 2: Biết cấu hình electron nguyên tử của một nguyên tố là 1s22s22p63s23p4 có thể suy ra:
Tổng số electron của nguyên tử đó là 16, vậy nguyên tố đó chiếm ô thứ 16 trong bảng tuần hoàn (vì nguyên tử có 16 electron, 16 proton, số đơn vị điện tích hạt nhân là 16, bằng số thứ tự của nguyên tố trong bảng tuần hoàn).
Nguyên tố đó thuộc chu kì 3 (vì có 3 lớp electron) thuộc nhóm VIA (vì có 6 electron lớp ngoài cùng). Đó là nguyên tố lưu huỳnh.
II. QUAN HỆ GIỮA VỊ TRÍ VÀ TÍNH CHẤT CỦA NGUYÊN TỐ
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra những tính chất hoá học cơ bản của nó:
- Tính kim loại, tính phi kim:
Các nguyên tố ở các nhóm IA, IIA, IIIA (trừ hiđro và bo) có tính kim loại Các nguyên tố ở các nhóm VA, VIA, VIIA (trừ antimon, bitmut và poloni) có tính phi kim.
- Hoá trị cao nhất của nguyên tố trong hợp chất với oxi, hoá trị của nguyên tố trong hợp chất với hiđro.
- Công thức oxit cao nhất.
- Công thức hợp chất khí với hiđro (nếu có).
- Công thức hiđroxit tương ứng (nếu có) và tính axít hay bazơ của chúng.
Thí dụ: Nguyên tố lưu huỳnh ở ô thứ 16, nhóm VIA, chu kì 3. Suy ra: lưu huỳnh là phi kim.
Hoá trị cao nhất với oxi là 6, công thức oxit cao nhất là SO3.
Hoá trị với hiđro là 2, công thức hợp chất khí với hiđro là H2S.
SO3 là oxit axít và H2SO4 là axít mạnh.
III. SO SÁNH TÍNH CHẤT HOÁ HỌC CỦA MỘT NGUYÊN TỐ VỚI CÁC NGUYÊN TỐ LÂN CẬN
Dựa vào quy luật của các nguyên tố trong bảng tuần hoàn có thể so sánh tính chất hoá học của một nguyên tố với các nguyên tố lân cận.
Thí dụ: So sánh tính chất hoá học của P (Z = 15) với Si (Z = 14) và S (Z = 16) với N (Z = 7) và As (Z = 33).
Trong bảng tuần hoàn, các nguyên tố Si, P, S thuộc cùng một chu kì. Nếp xếp theo chiều điện tích hạt nhân tăng dần ta được dãy Si, P, S. Trong chu kì, theo chiều điện tích hạt nhân tăng thì tính phi kim tăng. Vậy, P có tính phi kim yếu hơn S và mạnh hơn Si.
Trong nhóm VA, theo chiều điện tích hạt nhân tăng dần, ta có dãy N, P, As, tính phi kim giảm dần. P có tính phi kim kém hơn N và mạnh hơn As.
Vậy P có tính phi kim yếu hơn N và S, hiđroxit của nó là H3PO4 có tính axít yếu hơn HNO3 và H2SO4.
Bài 11:
LUYỆN TẬP
BẢNG TUẦN HOÀN, SỰ BIẾN ĐỔI TUẦN HOÀN CẤU HÌNH ELECTRON CỦA NGUYÊN TỬ VÀ TÍNH CHẤT CỦA
CÁC NGUYÊN TỐ HOÁ HỌC
A. KIẾN THỨC CẦN NẮM VỮNG
1. Cấu tạo bảng tuần hoàn
a) Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được sếp xếp theo chiều tăng dần của điện tích hạt nhân.
- Các nguyên tố có cùng lớp electron trong nguyên tử được xếp thành một hàng.
- Các nguyên tố có cùng số electron hoá trị như nhau được xếp thành một cột.
b) Ô nguyên tố: Mỗi nguyên tố xếp vào một ô
c) Chu kì
- Mỗi hàng là một chu kì.
- Bảng có 7 chu kì: 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
- Nguyên tử các nguyên tố thuộc một chu kì có số electron như nhau.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
d) Các nhóm A (từ IA đến VIIIA) gồm các nguyên tố ở chu kì nhỏ và chu kì lớn. Các nguyên tố nhóm IA, IIA là nguyên tố s, các nguyên tố từ nhóm IIIA đến VIIIA là nguyên tố p.
Các nhóm B ( từ IIIB đến VIIIB rồi IB và IIB theo chiều từ trái sang phải trong bảng hệ thống tuần hoàn) chỉ gồm các nguyên tố ở chu kì lớn. Các nguyên tố thuộc nhóm B là các nguyên tố d và f.
2. Sự biến đổi tuần hoàn
a) Cấu hình electron của nguyên tử
Số electron lớp ngoài cùng của nguyên tử các nguyên tố ở mỗi chu kì tăng từ 1 đến 8 thuộc các nhóm từ IA đến VIIIA. Cấu hình electron nguyên tử của các nguyên tố biến đổi tuần hoàn.
b) Sự biến đổi tuần hoàn tính kim loại, tính phi kim, bán kính nguyên tử và giá trị độ âm điện của các nguyên tử được tóm tắt trong bảng sau:
3. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Chú thích: Chiều mũi tên là chiều tăng
3. Định luật tuần hoàn
Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
Mk ghi hết các chất hoa học lun, hok tốt! (^O^)

Tham khảo:
Đối với các bạn học sinh, người bạn hàng ngày đến trường với mỗi người là thước kẻ, bút chì, sách vở,… nhưng cũng không thể nào thiếu được người bạn giúp chúng ta tẩy xóa lỗi sai chính là cục tẩy. Cục tẩy bé xinh mà có nguồn gốc ra đời vô cùng lâu đời và có nhiều công dụng đối với con người.
Cục tẩy đầu tiên ra đời cách đây đã hàng trăm năm trước, khi ấy bút chì còn được làm bằng chì và thiếc, rất cứng, người ta dùng ruột bánh mì để tẩy những chữ viết sai. Cùng với sự phát triển của bút chì, cục tẩy cũng có bước chuyển mình đáng kể. Người đầu tiên phát minh ra cục tẩy gần với cục tẩy hiện đại là một kĩ sư người anh tên là Edward Nairne, cục tẩy được phát minh trong một cuộc thi sáng chế, sau đó nó được sử dụng một cách rộng rãi và phổ biến trên thị trường.
Sau khi đạt giải ông Edward đã tâm sự, ông nảy ra ý tưởng làm chiếc tẩy này là do trên đường ông nhặt được miếng cao su và vô tình phát hiện ra tính năng tẩy các vết bẩn của nó. Dựa trên sự phát hiện đó ông đã sáng chế ra cục tẩy đầu tiên. Ta có thể thấy rằng những phát minh vĩ đại luôn đến với chúng ta một cách thật bất ngờ, người thông minh là người nhìn nhận ra vấn đề và đưa nó ứng dụng vào thực tế.
Cục tẩy có cấu tạo gồm hai phần: tẩy và vỏ tẩy. Vỏ của tẩy thường được làm bằng giấy cứng, trên có ghi mã vạch, nhãn hiệu hoặc có được trang trí bằng những hình ảnh bắt mắt khác nhau. Ruột tẩy rất đa dạng, phong phú về màu sắc: trắng, đen, xanh, đỏ,… thường được làm từ hỗn hợp dầu ăn, đá bọt và sulfur, chúng được kết dính với nhau nhờ cao su.
Có rất nhiều loại tẩy khác nhau. Có loại tẩy đi kèm với bút chì, chúng thường được gắn với đầu bút chì, khi viết sai có thể ngay lập tức sử dụng chúng để tẩy. Loại tẩy này thường có màu hồng, chứa cao su cứng nên việc tẩy đôi khi khó khăn, tẩy quá mạnh tay sẽ rách giấy nên ít khi được sử dụng.
Loại tẩy màu trắng dẻo, được làm từ nhựa vinyl tẩy dễ dàng, giấy sạch nên được ưa chuộng hơn. Ngoài ra còn một loại tẩy khác được gọi là tẩy nhào. Tẩy nhào ít xuất hiện trên thị trường, loại này mềm hơn hai loại trên rất nhiều, chúng ta có thể nhào trong tay như cục bột. Nó hấp thụ các hạt than chì ở bút chì nên khi tẩy sẽ không để lại vụn,… sử dụng loại tẩy này rất thích, vết bẩn được tẩy hoàn toàn, lại không gây bụi bẩn.
Ngoài ra, khoa học kĩ thuật hiện đại phát triển người ta còn phát minh ra tẩy điện, loại này có một chiếc nút bấm, khi cần tẩy chỉ cần ấn vào nút và đưa bút đến diện tích cần tẩy là sẽ xóa được hết vết bẩn. Loại này giá thành cao nhưng vết bẩn đi dễ dàng, giấy không bị xây xước và tiết kiệm được thời gian cho người sử dụng.
Sử dụng tẩy rất đơn giản, ngoài loại tẩy điện có cách sử dụng riêng thì các loại tẩy còn lại đều có cách sử dụng giống nhau. Khi viết sai chúng ta chỉ cần mài tẩy vào phần đó, chà đi chà lại một cách nhẹ nhàng là vết bẩn sẽ bay đi. Các bạn lưu ý, chớ chà mạnh sẽ khiến giấy rách.
Khi sử dụng xong tẩy chúng ta chỉ cần cất gọn gàng. Tránh để tẩy rơi xuống đất, khi tẩy bị bám bẩn các bạn dùng cho lần tiếp theo sẽ vấy bẩn lên trang giấy. Vật dụng nào cũng vậy, khi sử dụng xong chúng ta cần cất cẩn thận, thì mới có thể dụng chúng lâu dài được.
Tẩy là một công cụ phổ biến trong học tập của học sinh, sinh viên, người thiết kế,… nó có ý nghĩa quan trọng với mỗi người. Cục tẩy giúp ta xóa đi những phần viết sai, viết nhầm,..
Từ khi được phát minh cho đến bây giờ tẩy luôn được mọi người ưa chuộng. Dù khoa học kĩ thuật có phát triển hơn nữa, tẩy vẫn sẽ là người bạn đồng hành với các bạn học sinh, sinh viên, kĩ sư,…
Tham khảo:
Đối với các bạn học sinh, người bạn hàng ngày đến trường với mỗi người là thước kẻ, bút chì, sách vở,… nhưng cũng không thể nào thiếu được người bạn giúp chúng ta tẩy xóa lỗi sai chính là cục tẩy. Cục tẩy bé xinh mà có nguồn gốc ra đời vô cùng lâu đời và có nhiều công dụng đối với con người.
Cục tẩy đầu tiên ra đời cách đây đã hàng trăm năm trước, khi ấy bút chì còn được làm bằng chì và thiếc, rất cứng, người ta dùng ruột bánh mì để tẩy những chữ viết sai. Cùng với sự phát triển của bút chì, cục tẩy cũng có bước chuyển mình đáng kể. Người đầu tiên phát minh ra cục tẩy gần với cục tẩy hiện đại là một kĩ sư người anh tên là Edward Nairne, cục tẩy được phát minh trong một cuộc thi sáng chế, sau đó nó được sử dụng một cách rộng rãi và phổ biến trên thị trường.
Sau khi đạt giải ông Edward đã tâm sự, ông nảy ra ý tưởng làm chiếc tẩy này là do trên đường ông nhặt được miếng cao su và vô tình phát hiện ra tính năng tẩy các vết bẩn của nó. Dựa trên sự phát hiện đó ông đã sáng chế ra cục tẩy đầu tiên. Ta có thể thấy rằng những phát minh vĩ đại luôn đến với chúng ta một cách thật bất ngờ, người thông minh là người nhìn nhận ra vấn đề và đưa nó ứng dụng vào thực tế.
Cục tẩy có cấu tạo gồm hai phần: tẩy và vỏ tẩy. Vỏ của tẩy thường được làm bằng giấy cứng, trên có ghi mã vạch, nhãn hiệu hoặc có được trang trí bằng những hình ảnh bắt mắt khác nhau. Ruột tẩy rất đa dạng, phong phú về màu sắc: trắng, đen, xanh, đỏ,… thường được làm từ hỗn hợp dầu ăn, đá bọt và sulfur, chúng được kết dính với nhau nhờ cao su.
Có rất nhiều loại tẩy khác nhau. Có loại tẩy đi kèm với bút chì, chúng thường được gắn với đầu bút chì, khi viết sai có thể ngay lập tức sử dụng chúng để tẩy. Loại tẩy này thường có màu hồng, chứa cao su cứng nên việc tẩy đôi khi khó khăn, tẩy quá mạnh tay sẽ rách giấy nên ít khi được sử dụng.
Loại tẩy màu trắng dẻo, được làm từ nhựa vinyl tẩy dễ dàng, giấy sạch nên được ưa chuộng hơn. Ngoài ra còn một loại tẩy khác được gọi là tẩy nhào. Tẩy nhào ít xuất hiện trên thị trường, loại này mềm hơn hai loại trên rất nhiều, chúng ta có thể nhào trong tay như cục bột. Nó hấp thụ các hạt than chì ở bút chì nên khi tẩy sẽ không để lại vụn,… sử dụng loại tẩy này rất thích, vết bẩn được tẩy hoàn toàn, lại không gây bụi bẩn.
Ngoài ra, khoa học kĩ thuật hiện đại phát triển người ta còn phát minh ra tẩy điện, loại này có một chiếc nút bấm, khi cần tẩy chỉ cần ấn vào nút và đưa bút đến diện tích cần tẩy là sẽ xóa được hết vết bẩn. Loại này giá thành cao nhưng vết bẩn đi dễ dàng, giấy không bị xây xước và tiết kiệm được thời gian cho người sử dụng.
Sử dụng tẩy rất đơn giản, ngoài loại tẩy điện có cách sử dụng riêng thì các loại tẩy còn lại đều có cách sử dụng giống nhau. Khi viết sai chúng ta chỉ cần mài tẩy vào phần đó, chà đi chà lại một cách nhẹ nhàng là vết bẩn sẽ bay đi. Các bạn lưu ý, chớ chà mạnh sẽ khiến giấy rách.
Khi sử dụng xong tẩy chúng ta chỉ cần cất gọn gàng. Tránh để tẩy rơi xuống đất, khi tẩy bị bám bẩn các bạn dùng cho lần tiếp theo sẽ vấy bẩn lên trang giấy. Vật dụng nào cũng vậy, khi sử dụng xong chúng ta cần cất cẩn thận, thì mới có thể dụng chúng lâu dài được.
Tẩy là một công cụ phổ biến trong học tập của học sinh, sinh viên, người thiết kế,… nó có ý nghĩa quan trọng với mỗi người. Cục tẩy giúp ta xóa đi những phần viết sai, viết nhầm,..
Từ khi được phát minh cho đến bây giờ tẩy luôn được mọi người ưa chuộng. Dù khoa học kĩ thuật có phát triển hơn nữa, tẩy vẫn sẽ là người bạn đồng hành với các bạn học sinh, sinh viên, kĩ sư,…

em thấy môi trường hiện nay đang rất ô nhiễm , ở trường THCS Đại Đồng cũng vậy không khí bị ô nhiễm nặng bởi khói thuốc lá, khói vape, đánh r*m,...
chỉ mang tính chất giải chí

“Ngày đầu tiên đi học, mẹ dắt em tới trường, em vừa đi vừa khóc. Mẹ dỗ dành yêu thương,...” Đó là những cảm xúc đầu tiên của tôi khi chuẩn bị vào lớp một. Khi tôi ngân nga bài hát này thì lòng tôi lại nhớ đến những kỉ niệm đẹp của ngày đầu tiên đi học.
Nhớ lại lúc ấy, cái thuở tôi còn bé xíu cùng mẹ bước chân vào một ngôi trường tiếu học rộng thênh thang. Khi mới vừa bước chân vào trường thì tôi nắm lấy tay mẹ tôi thật chặt chứ không như những lúc ở nhà; đi đâu cùng được và cũng chẳng sợ gi. Có lẽ vì tôi đã quá quen với từng con hèm nhỏ ở nhà tôi nên tôi chẳng sợ gì cả, tôi chạy bỏ mẹ lại thật xa. Vậy mà lúc ấy tôi lại chẳng dám rời khỏi mẹ dù chỉ một bước. Giờ học bắt đầu, cồng trường đóng lại, tôi bơ vơ trong lớp nhìn ra ngoài cổng xem còn có mẹ không. Tôi như ở một thế giới hoàn toàn khác khi tôi vừa chia tay mẹ. Lúc đó tôi chẳng biết phải làm gì chỉ biết đứng đỏ mà khóc. Và rồi, cô đến bên tôi, cô nắm lấy tay tôi và cô nói ràng: “Đừng sợ, có cô đây” Tôi nghe cô nói, lời nói thật ngọt ngào và dịu dàng biết bao. Tôi cứ ngỡ cô là người mẹ thứ hai của tôi, che chở, quan tâm, chăm sóc và dạy dỗ tôi. Tôi lúc ấy không còn đi chơi như ngày trước nữa mà tôi đã đi học.
Ngày đầu đi học thật khó, tôi chẳng biết gì cả. Tôi chẳng biết cầm bút, chẳng biết sách vở là gì nhưng điều đó chẳng khó gì khi có cô bên cạnh tôi. Cô đã chỉ tôi cách cầm bút, tập cho tôi viết chữ. Và rồi ba tiếng trống trường vang lên, báo hiệu giờ về đã đến. Những bạn khác thì được ba mẹ đón về nhà. Cô cũng về nhà, chỉ còn lại một mình tôi - cậu học trò lớp một cô đơn trong căn phòng lạnh lẽo. Tôi đã khóc, khóc rất to rồi đột nhiên có ai đó khẽ đặt tay lên vai tôi và nói: “Mình về nhà thôi con”, lúc đó tôi mới nhận ra là mẹ đã ở bên tôi.
Ôi! Sao tôi thương đến thế, sao tôi nhớ đến thế. Cái ngày đầu tiên đi học của tôi. Cái ngày mà tôi có nhiều ki niệm nhất trong tuổi thơ của mình.
Tuổi thơ tôi gắn liền với biết bao kỉ niệm, nào là vui, là buồn. Có lúc, những kỉ niệm ấy là những khoảng thời gian làm cho tôi không thể nào quên đi được. Khoảnh khắc luôn làm cho tôi nhớ chính là những kỉ niệm ngày đầu tiên vào học lớp sáu, vào học một ngôi trường cấp hai với biết bao điều lí thú xuất hiện.
Hôm ấy, trước ngày khai trường, tôi trằn trọc suốt đêm, không thể nào ngủ được. Bởi vì trong lòng tôi cảm thấy rất hồi hộp và không biết ngày khai trường được diễn ra có giống hồi tôi học ở trường cấp một ngày ấy hay không ? Cảm giác của tôi vào hôm ấy không tài nào tả được. Rồi ngày mà tôi luôn tò mò cùng đã đến.
Sáng tinh mơ, lần đầu tiên tôi dậy sớm. Xong xuôi những việc cá nhân, tôi vội vã chạy vào phòng với vẻ mặt hớn hở. Tôi nhanh tay lấy bộ đồng phục ra, trông nó mới và trẳng tinh. Tôi nhẹ nhàng thay bộ đồng phục ấy, cột lên thêm chiếc khăn quàng đỏ thắm, nhìn vào gương, tôi tự nghĩ rằng, giờ mình đã là một nữ sinh cấp hai rồi, cần phải chững chạc hơn, ra vẻ nữ sinh hơn. Thay quần áo xong, tôi chạy xuống phỏng ăn, ăn sáng cùng gia đình. Ai ai cũng bảo rằng tôi đã khôn lớn hơn rôi. Tôi cũng nghĩ vậy.
Ăn một bữa no nê vào buổi sáng, tôi vội chào tạm biệt cả nhà và lấy chiếc xe đạp ra. Tôi chạy từ từ đến trường, cảm giác lúc bấy giờ của tôi rất là vui. Khi đến trường, toàn trường náo nhiệt như những ngày lễ vậy.
Ngoài cổng trường, cửa chính mở toang ra đội trống liền xếp thành hai hàng ngang, khi có khách hoặc giáo viên bước vào, trống kèn sẽ vang lên như thể chào mừng họ vậy. Sân trước của trường treo những dây với những lá cờ đủ màu bay phấp phới. Mọi thứ trông rẩt mới mẻ và lạ lẫm. Các giáo viên cùng thế, các cỏ giáo thì mặc những bộ áo dài mới. Còn các thầy thì mặc những chiếc áo sơ mi trang trọng với chiếc cà vạt đủ màu sẳc. Bên trong trường có sân khấu to, bên trên sân khấu có những bó hoa tươi dùng để trưng bày. Các cửa cầu thang đều đóng lại kín mít. Khối sáu chúng em được thầy tổng phụ trách và thầy giám thị sắp xếp hàng lối cho từng lớp. Còn ba khối, bảy, tám, chín được xếp theo sự điều động của thầy Sơn giám thị. Không khí lúc đó rất náo nhiệt. Mỗi lớp sáu chúng em được cô chủ nhiệm mua cho mỗi lớp mười cái bong bóng. Buổi lề khai giảng bắt đầu, từng lớp chúng em được bước vào trên tấm thảm đỏ cùng với lời giới thiệu mỗi lớp của cô dẫn chương trình. Sau những lời giới thiệu chính là lúc chúng tôi được thả lên trời những quả bóng, là lúc mà ai trong lòng cũng thấy toại nguyện. Sau những lời giới thiệu, phần phát biểu cùa thầy hiệu trưởng là kết thúc buổi lễ, khi mồi học sinh toàn trường bước ra khỏi trường sau một buổi lễ khai giảng đầy niềm vui. Tôi nghĩ rằng từ nay tôi chính thức là một nữ sinh cấp hai.
Giờ đây tôi đã lên lớp tám nhưng kỉ niệm ngày đầy tiên đi học quả thật rất đáng nhớ.Vừa được làm quen với các bạn bè, vừa được học thêm nhiều môn học mới và cả qui luật mới. Một kỉ niệm tràn đầy niềm vui sướng với mênh mông, bao la những điều mới mẻ. Thật hạnh phúc biết bao! Đúng là một kỉ niệm khó nhạt phai trong kí ức tuổi thơ tôi.


Trong công cuộc đổi mới của Ðảng, tuổi trẻ Việt Nam đã "hành quân theo bước chân những người anh hùng", "hành quân theo chân Bác", tiếp bước cha anh đi đầu trong công cuộc đổi mới, 2 phong trào "thanh niên lập nghiệp", "tuổi trẻ giữ nước" đã động viên hàng triệu đoàn viên thanh niên tham gia, đã xuất hiện nhiều tấm gương điển hình trong lao động, chiến đấu, học tập, xây dựng cuộc sống mới.
Các phong trào "Xứng danh anh bộ đội cụ Hồ" thực hiện "6 điều Bác Hồ dạy", "Ðoàn kết 3 lực lượng", "Ðền ơn đáp nghĩa", "Sản xuất, kinh doanh giỏi", "3 mục tiêu dân số, sức khỏe, môi trường", "Dạy tốt, học tốt". "Học vì ngày mai lập nghiệp" … là biểu hiện cụ thể những cố gắng, nỗ lực vượt bậc của tuổi trẻ Việt Nam trong, thời kỳ công nghiệp hóa hiện đại hóa đất nước, thực hiện mục tiêu "dân giàu, nước mạnh, xã hội công bằng, văn minh". Ðại hội đại biểu Ðoàn Thanh niên cộng sản Hồ Chí Minh toàn quốc lần thứ VII (1997) lại một lần nữa khẵng định khẩu hiệu hành động của tuổi trẻ trong thời kỳ mới "Thanh niên Việt Nam xung kích, sáng tạo vì sự nghiệp công nghiệp hóa - hiện đại hóa đất nước; vì tương lai tươi sáng của tuổi trẻ".
Từ nội dung chính này bạn có thể tự viết thành một bài cho riêng mình.
Người thanh niên học tập rèn luyện vì ngày mai lập nghiệp trước hết phải thể hiện tính tự lập của mình!

ღ♡ÇØ₤ᗪ❤ßØƔ.♡๖ۣۜŦεαм♡❤Ɠ长♡ღ
Kết bạn
Ai muốn Bt về mik hơn thik đây https://vn.hellomate.me/sync-quiz/433 ░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░ ░░░███░███░███░███░█░█░░░░░░░░░░░░░░░░░░░░░░░░░░░░░ ░░░█░░░█░█░░█░░█░█░█░█░░░░░░░░░░░░░░░░░░░░░░░░░░░░░ ░░░███░███░░█░░██░░░█░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░ ░░░█░░░█░█░░█░░█░█░░█░░░░░░░░░░░░░████░░█████░░░██░ ░░░█░░░█░█░███░█░█░░█░░░░░░░░░░░░████░░█████░░░███░ ░░░░░░░░░░░░░░░░░░░░░░░░██░░░░░░████░░█████░░░████░ ░░░░░░░░░░░░░░░░░░░███████░██░░█████░██████░░██░██░ ░░░░░░░░░░░░█████████████░███░██████░█████░░░░░░██░ ░░░░░░░░░███████████████░████░██████░█████░░░░░░██░ ░░░░░░░█████████████████████░██████░██████░░░░░░██░ ░░░░░██████████████████████░███████░█████░░░░░░███░ ░░░░░█████████████████████████████░██████░░░░░████░ ░░░░████████████████████████████████████░░░░░████░░ ░░░░███████████████████████████████████░░░░█████░░░ ░░░░█████░░░░░░░░████████████████████░░░░██████░░░░ ░░░░░██░░░░░░░░░░████████████████████████████░░░░░░ ░░░░░░░░░░░░░░░░░██████████████████████████░░░░░░░░ ░░░░░░░░░░░░░░░░░░░████████████████████░░░░░░░░░░░░ ░░░░░░░░░░░░░░░░░░░░░░░█████████████░░░░░░░░░░░░░░░ ░░░░░░░░░░░░░░░░░░░░░░░████████░░░░░░░░░░░░░░░░░░░░ ░░░░░░░░░░░░░░░░░░░████████░░░░░░░░░░░░░░░░░░░░░░░░ ░░░░░░░██░░░░░░░███████░░░░░░███░███░███░█░░░░░░░░░ ░░░░░░███░░░███████░░░░░░░░░░░█░░█░█░░█░░█░░░░░░░░░ ░░░░███████████░░░░░░░░░░░░░░░█░░███░░█░░█░░░░░░░░░ ░░░████████░░░░░░░░░░░░░░░░░░░█░░█░█░░█░░█░░░░░░░░░ ░░████░░░░░░░░░░░░░░░░░░░░░░░░█░░█░█░███░███░░░░░░░ ░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░░ ────████████████───────████████████ ──████▓▓▓▓▓▓▓▓▓▓██───███▓▓▓▓▓▓▓▓▓████ ─███▓▓▓▓▓▓▓▓▓▓▓▓▓██─██▓▓▓▓▓▓▓▓▓▓▓▓▓███ ███▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓███▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓███ ██▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓█▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓██ ██▓▓▓▓▓▓▓▓▓──────────────────▓▓▓▓▓▓▓▓██ ██▓▓▓▓▓▓▓─██───████─█──█─█████─▓▓▓▓▓▓██ ██▓▓▓▓▓▓▓─██───█──█─█──█─██────▓▓▓▓▓▓██ ███▓▓▓▓▓▓─██───█──█─█──█─█████─▓▓▓▓▓▓██ ███▓▓▓▓▓▓─██───█──█─█──█─██────▓▓▓▓▓▓██ ─███▓▓▓▓▓─████─████─████─█████─▓▓▓▓███ ───███▓▓▓▓▓──────────────────▓▓▓▓▓▓███ ────████▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓████ ───────████▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓▓█████ ──────────████▓▓▓▓▓▓▓▓▓▓▓▓████ ─────────────███▓▓▓▓▓▓▓████ ───────────────███▓▓▓███ ▄║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄║║║▄▄▄▄▄▄║║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄║║║▄▄▄▄▄║║║║║║▄▄▄║║║║║▄▄║║║║║║▄▄║║║▄║║║▄ ▄║║║▄▄▄▄▄║║║║║║║▄║║║║║║║▄║║║║║║║▄║║║▄║║║▄ ▄║║║║║║▄▄▄▄▄▄║║║▄║║║▄║║║▄║║║▄║║║▄║║║║║║║▄ ▄║║║║║║║▄║║║║║║║▄║║║║║║║▄║║║║║║║▄║║║║║║▄▄ ▄║║║║║║║▄║║▄▄║║║▄║║║║║║║▄║║║║║║║▄▄▄║║║║▄▄ ▄║║║▄▄║║▄║║▄▄║║║▄║║║▄▄▄▄▄║║║▄▄▄▄▄▄║║║║▄▄▄ ▄║║║▄▄║║▄║║║║║║║▄║║║▄▄▄▄▄║║║▄▄▄▄▄║║║║║▄▄▄ ▄║║║▄▄║║▄▄║║║║║▄▄║║║▄▄▄▄▄║║║▄▄▄▄▄║║║║▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║▄▄▄▄▄║║║▄▄▄▄▄║║║▄▄▄▄▄ ▄▄▄▄▄▄▄║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄▄▄▄║║║║║▄▄║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄▄▄║║║║║║▄║║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄▄║║║║║║║▄║║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄▄║║║║║║▄║║║║▄▄▄▄▄║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄║║║║║║║▄║║║║▄▄║║║║║║║║▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄ ▄▄▄║║║║║║║║║║║▄▄║║║║║║║║║║▄▄║║▄▄▄▄▄▄▄▄▄▄▄ ▄▄║║║║║║║║║║║▄▄║║║║║▄▄║║║▄▄║║║║║▄▄▄▄▄▄▄▄▄ ▄║║║║║▄║║║║║║▄║║║║║║║║║║║▄║║║║║▄▄▄║║║║▄▄▄ ▄║║║║▄▄║║║║║▄▄║║║║║║║║║║▄▄║║║║▄▄▄║║║║║▄▄▄ ▄║║║║▄▄║║║║▄▄║║║║║▄▄▄▄▄▄▄║║║║▄║║▄║║║║▄▄▄▄ ▄▄▄▄▄▄▄║║║▄▄▄║║║║║║║║║║▄▄║║║║║║║║║║║▄▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║║║║║║║▄║║║║║║║║║║║▄▄▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║║║║║▄▄║║║║║║║║║║▄▄▄▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║║▄║║║║▄▄▄▄▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║▄║║║║▄▄▄▄▄▄▄▄▄ ▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄║║║▄▄▄▄▄▄▄▄▄▄ ▄║║║║▄▄║║║▄▄║║║║║║║║▄▄▄║║║║║▄▄▄▄║║║║║║▄▄▄ ▄║║║║▄▄║║║▄▄║║║║║║║║▄▄║║║║║║║▄▄║║║║║║║║▄▄ ▄║║║║║║║║║▄▄║║║║║║║║▄▄║║║║║║║▄▄║║║▄▄▄║║║▄ ▄▄║║║║║║║║▄▄║║║▄▄▄▄▄▄▄║║║▄║║║▄▄║║║▄▄▄║║║▄ ▄▄║║║║║║║║▄▄║║║║║║║▄▄║║║║▄║║║▄▄║║║║║║║║║▄ ▄▄▄║║║║║║▄▄▄║║║║║║║▄▄║║║║║║║║║▄║║║║║║║║║▄ ▄▄▄▄║║║║▄▄▄▄║║║║║║║▄▄║║║║║║║║║▄║║║║║║║▄▄▄ ▄▄▄▄║║║║▄▄▄▄║║║║▄▄▄▄▄║║║║▄║║║║▄║║║║║║║║▄▄ ▄▄▄▄║║║║▄▄▄▄║║║║║║║║▄║║║║▄║║║║▄║║║▄▄║║║║▄ ▄▄▄▄║║║║▄▄▄▄║║║║║║║║▄║║║║▄║║║║▄║║║▄▄║║║║▄ ▄▄▄▄║║║║▄▄▄▄║║║║║║║║▄║║║║▄▄║║║▄║║║▄▄▄║║║▄ ──────▄▌▐▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▌ ───▄▄██▌█ BEEP-BEEP-BEEP-BEEP-BEEP-BEEP-BEEP- ███████▌█▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▄▌ ▀(@)▀▀▀▀▀▀▀(@)(@)▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀▀(@) ▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒▒ ▒▒▄▄▄▒▒▒█▒▒▒▒▄▒▒▒▒▒▒▒▒ ▒█▀█▀█▒█▀█▒▒█▀█▒▄███▄▒ ░█▀█▀█░█▀██░█▀█░█▄█▄█░ ░
a, Al2O3
b, KCl+O2
c,FeCl2+H2
hok tốt