
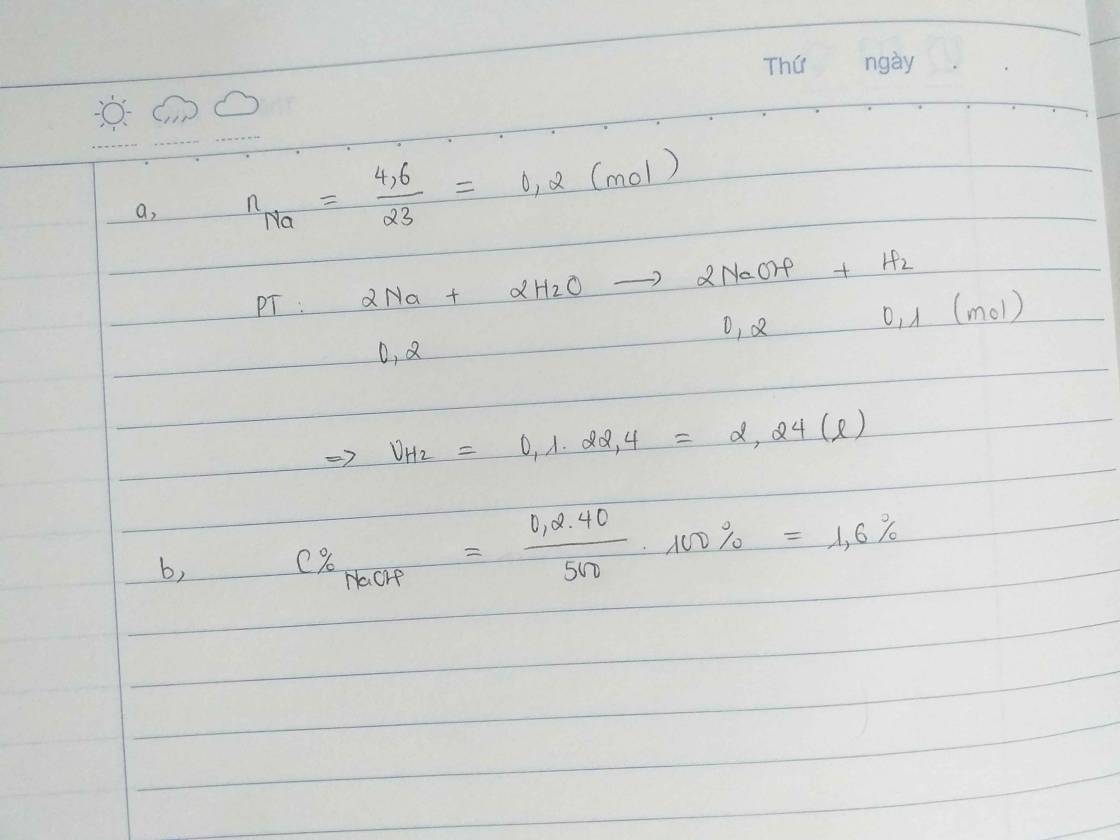
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

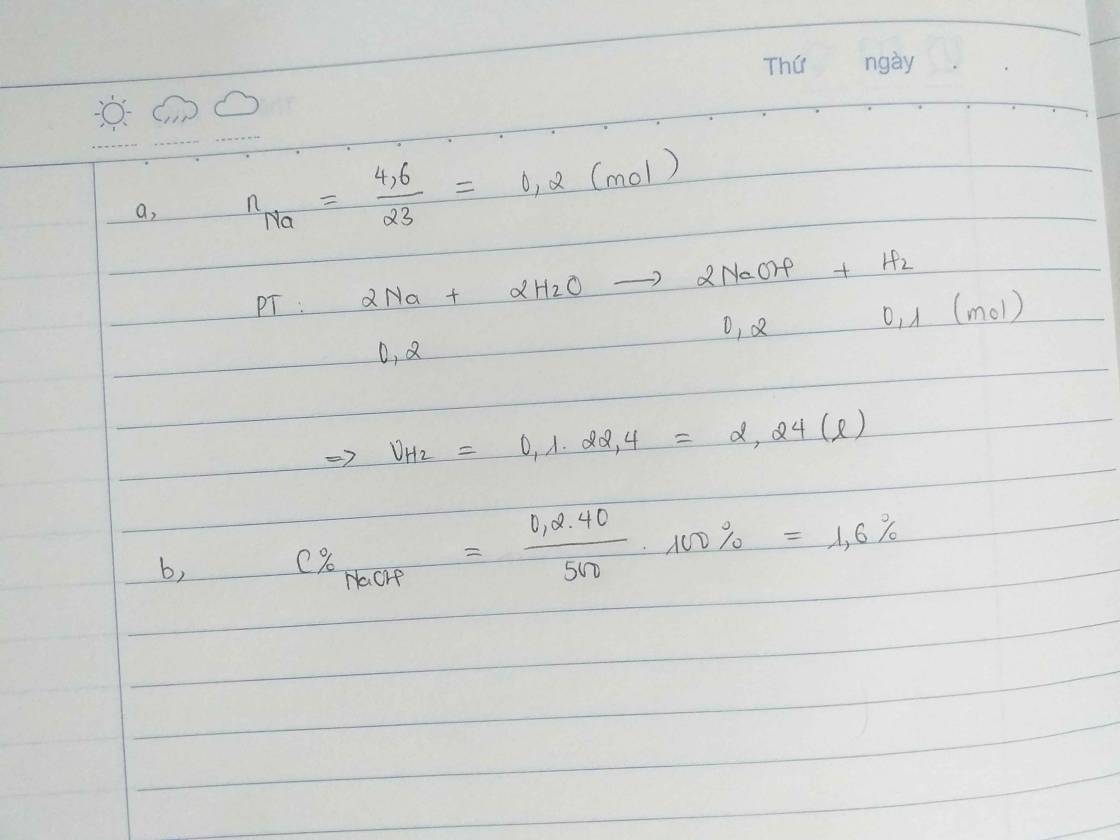

nNa=4,6/23=0,2(mol)
a) PTHH: 2 Na + 2 H2O -> 2 NaOH + H2
b) Ta có: nNaOH=nNa=0,2(mol)
=>mNaOH=0,2.40=8(g)
nH2= 1/2 . nNa=1/2. 0,2=0,1(mol)
=>V=V(H2,đktc)=0,1.22,4=2,24(l)
Số mol của natri
nNa = \(\dfrac{m_{Na}}{M_{Na}}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
a) Pt : 2Na + 2H2O → 2NaOH + H2\(|\)
2 2 2 1
0,2 0, 0,1
Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,1. 22,4
= 2,24 (l)
Số mol của natri hidroxit
nNaOH = \(\dfrac{0,1.2}{1}=0,2\left(mol\right)\)
Khối lượng của natri hidroxit
mNaOH = nNaOH . MNaOH
= 0,2 . 40
= 8 (g)
Chúc bạn học tốt

\(a) 2Na + 2H_2O \to 2NaOH + H_2\\ Na_2O + H_2O \to 2NaOH\\ n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)\\ n_{Na} = 2n_{H_2} = 0,3(mol) \Rightarrow m_{Na} = 0,3.23 = 6,9(gam)\\ b) n_{Na_2O} = \dfrac{19,3-6,9}{62} = 0,2(mol)\\ n_{NaOH} = n_{Na} + 2n_{Na_2O} = 0,7(mol)\\ m_{dd} = 19,3 + 181 - 0,15.2 = 200(gam)\\ C\%_{NaOH} = \dfrac{0,7.40}{200}.100\% = 14\%\)

a, \(2Na+2H_2O\rightarrow2NaOH+H_2\)
Ta có: \(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\)
\(n_{H_2O}=\dfrac{200}{18}=\dfrac{100}{9}\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{2}< \dfrac{\dfrac{100}{9}}{2}\), ta được H2O dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{Na}=0,05\left(mol\right)\Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)
b, Theo PT: \(n_{NaOH}=n_{Na}=0,1\left(mol\right)\)
Ta có: m dd sau pư = 2,3 + 100 - 0,05.2 = 102,2 (g)
\(\Rightarrow C\%_{NaOH}=\dfrac{0,1.40}{102,2}.100\%\approx3,91\%\)
c, - Dung dịch làm quỳ tím hóa xanh.
\(n_{Na}=\dfrac{2,3}{23}=0,1\left(mol\right)\\ 2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{H_2}=\dfrac{0,1}{2}=0,05\left(mol\right);n_{NaOH}=n_{Na}=0,1\left(mol\right)\\ a,V=V_{H_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,m_{ddNaOH}=m_{Na}+m_{H_2O}-m_{H_2}=2,3+200-0,05.2=202,2\left(g\right)\\ C\%_{ddNaOH}=\dfrac{40.0,1}{202,2}.100\approx1,978\%\\ c,NaOH-Tính.bazo\Rightarrow Quỳ.tím.hoá.xanh\)

\(n_K=\dfrac{7,8}{39}=0,2\left(mol\right)\\
pthh:2K+2H_2O->2KOH+H_2\)
0,2 0,2 0,2 0,1
=> \(V_{H_2}=0,1.22,4=2,24\left(L\right)\)
\(m_{H_2O}=0,2.18=3,6\left(g\right)\\
m_{KOH}=0,2.56=11,2\left(g\right)\)

\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\
PTHH:Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
0,05 0,05
\(\rightarrow m=0,05.137=6,85\left(g\right)\)

PT: \(2K+2H_2O\rightarrow2KOH+H_2\)
\(Ba+2H_2O\rightarrow Ba\left(OH\right)_2+H_2\)
\(K_2O+H_2O\rightarrow2KOH\)
\(BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
Ta có: \(n_{H_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
Theo PT, có: \(\Sigma n_{H_2}=\dfrac{1}{2}n_K+n_{Ba}\)
\(\Rightarrow n_K+2n_{Ba}=0,04\left(1\right)\)
Ta có: \(n_{KOH}=\dfrac{2,24}{56}=0,04\left(mol\right)\)
Theo PT: \(\Sigma n_{KOH}=n_K+2n_{K_2O}\)
\(\Rightarrow n_K+2n_{K_2O}=0,04\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_K+2n_{Ba}=n_K+2n_{K_2O}\) \(\Rightarrow n_{Ba}=n_{K_2O}=\dfrac{0,04-n_K}{2}\) (3)
Mà: mA = 4,62 (g)
\(\Rightarrow39n_K+137n_{Ba}+94n_{K_2O}+153n_{BaO}=4,62\) (4)
Từ (3) và (4) \(\Rightarrow2n_{BaO}=n_K\) (5)
Từ (1) và (5) \(\Rightarrow n_{BaO}+n_{Ba}=\dfrac{0,04}{2}=0,02\left(mol\right)\)
Theo PT: \(\Sigma n_{Ba\left(OH\right)_2}=n_{Ba}+n_{BaO}=0,02\left(mol\right)\)
\(\Rightarrow m_{Ba\left(OH\right)_2}=0,02.171=3,42\left(g\right)\)
Tuy cách này vận dụng toán nhiều hơn hóa nhưng bạn tham khảo nhé!
Coi A gồm : K,Ba,O
Ta có : \(n_K = n_{KOH} = \dfrac{2,24}{56} = 0,04(mol)\)
Gọi :\(\left\{{}\begin{matrix}n_{Ba}=a\left(mol\right)\\n_O=b\left(mol\right)\end{matrix}\right.\)⇒ 137a + 16b = 4,62 - 0,04.39 = 3,06(1)
Bảo toàn e :
\(n_K + 2n_{Ba} = 2n_{H_2} + 2n_O\\ \Rightarrow 2a - 2b = 0(2)\)
Từ (1)(2) suy ra a = 0,02 ; b = 0,02
Vậy :
\(n_{Ba(OH)_2} = n_{Ba} = 0,02(mol)\\ \Rightarrow m_{Ba(OH)_2} = 0,02.171 = 3,42(gam)\)

Gọi nFe=a(mol);nM=b(mol)⇒56a+Mb=9,6(1)
Fe+2HCl→FeCl2+H2
M+2HCl→MCl2+H2
nH2=a+b=0,2⇒a=0,2−b
Ta có :
56a+Mb=9,656a+Mb=9,6
⇔56(0,2−b)+Mb=9,6
⇔Mb−56b=−1,6
⇔b(56−M)=1,6
⇔b=1,656−M
Mà 0<b<0,20<b<0,2
Suy ra : 0<1,656−M<0,20<1,656−M<0,2
⇔M<48(1)
M+2HCl→MCl2+H2
nM=nH2<5,622,4=0,25
⇒MM>4,60,25=18,4
+) Nếu M=24(Mg)
Ta có :
56a+24b=9,656a+24b=9,6
a+b=0,2a+b=0,2
Suy ra a = 0,15 ; b = 0,05
mFe=0,15.56=8,4(gam)
mMg=0,05.24=1,2(gam)
+) Nếu M=40(Ca)
56a+40b=9,656a+40b=9,6
a+b=0,2
Suy ra a = b = 0,1
mCa=0,1.40=4(gam)
mFe=0,1.56=5,6(gam)

\(n_{Na}=\dfrac{13,8}{23}=0,6\left(mol\right)\\ pthh:Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,6 0,6 0,3
\(V_{H_2}=0,3.22,4=6,72\left(l\right)\\ c,m_{\text{dd}}=13,8+286,8-\left(0,3.2\right)=300\left(g\right)\\ C\%=\dfrac{0,6.40}{300}.100\%=8\%\)
\(n_{Na}\) = \(\dfrac{13,8}{23}\) = 0,6 mol
Theo PTHH:
a) \(2Na+2H_2O\underrightarrow{t^o}2NaOH+H_2\)
2 2 2 1 (mol)
0,6 \(\rightarrow\) 0,6 \(\rightarrow\) 0,6 \(\rightarrow\) 0,3 (mol)
b) \(V_{H_2}\) = 0,3.22,4 = 6,72l
c) \(m_{dd}\) = 13,8 + 286,8 - 0,3.2 = 300g
\(C\%\) = \(\dfrac{0,6.40}{300}\).100% = 8%