Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A

Tỉ khối hỗn hợp trước so với hỗn hợp sau phản ứng là 0,9.
→Khối lượng mol của hỗn hợp khí sau phản ứng là 8,5 : 0,9=85/9 (g/mol)


Chọn D
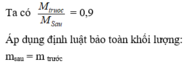
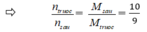
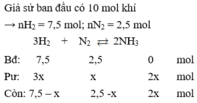
(Do ban đầu số mol N2 : H2 = 1 : 3 → hiệu suất tính theo H2 hoặc N2)
Sau phản ứng n = nH2 + nN2 + nNH3 = 7,5 - 3x + 2,5 – x + 2x = 10 – 2x = 9
→ x = 0,5 ⇒ H% = (0,5/2,5). 100% = 20%

Đáp án D
Dễ thấy hiệu suất tính theo N2
Giả sử X N 2 : 1 H 2 : 4
![]()

Gọi hh khí ban đầu là X và hh khí sản phẩm là Y.
\(d_{\dfrac{X}{H_2}}=3,6\rightarrow M_X=3,6.2=7,2\left(\dfrac{g}{mol}\right)\)
Ta có:
\(\dfrac{n_{N_2}}{n_{H_2}}=\dfrac{7,2-2}{28-7,2}=\dfrac{5,2}{20,8}=\dfrac{1}{4}\) ( quy tắc đường chéo )
Gọi x là số mol N2 tham gia phản ứng.
PTHH:
\(N_2+3H_2\xrightarrow[Fe]{t^o}2NH_3\)
Trc p/ư: 1 4
p/ư: x 3x 2x (mol)
sau p/ư: 1-x 4-3x 2x
\(\rightarrow n_Y=1-x+4-3x+2x=5-2x\left(mol\right)\)
\(d_{\dfrac{Y}{H_2}}=4,5\rightarrow M_Y=4,5.2=9\left(\dfrac{g}{mol}\right)\)
BTKL: mX = mY
\(m_Y=1.28+4.2=36\left(g\right)\)
\(\rightarrow\dfrac{36}{9}=5-2x\)
\(\rightarrow x=0,5\)
Giả sử phản ứng xảy ra hoàn toàn:
\(\dfrac{1}{1}< \dfrac{4}{3}\) --> N2 hết, H2 dư.
Trước:
\(\%V_{N_2}=\dfrac{1.22,4}{5.22,4}.100\%=20\%\)
\(\%V_{H_2}=100\%-20\%=80\%\)
Sau:
\(\%V_{NH_3}=\dfrac{1.22,4}{4.22,4}.100\%=25\%\)
\(\%V_{N_2}=\dfrac{\left(1-0,5\right).22,4}{4.22,4}.100\%=12,5\left(\%\right)\)
\(\%V_{H_2}=\dfrac{\left(4-1,5\right).22,4}{4.22,4}.100\%=62,5\%\)


Gọi số mol N2 ban đầu là x
số mol H2 ban đầu là 3x
số mol N2 phản ứng là a
Ta có PT:
N2 + 3H2 ⇌ 2NH3
Số mol hh B \(\left\{{}\begin{matrix}N_2:x-a\left(mol\right)\\H_2:3x-3a\left(mol\right)\\NH_3:2a\left(mol\right)\end{matrix}\right.\)
Ta có: \(\overline{M}_A\)=\(\frac{m_A}{n_A}\); \(\overline{M}_B\)= \(\frac{m_B}{n_B}\)
và mA = mB
=> dA/B = \(\frac{\overline{M}_A}{\overline{M_B}}\)=\(\frac{n_A}{n_B}\)=0,6
Mà nA = x + 3x = 4x, nB = 4x - 2a
=> \(\frac{4x-2a}{4a}=0,6\)=> a = 0,8x
H = \(\frac{a}{x}.100\%=80\%\)