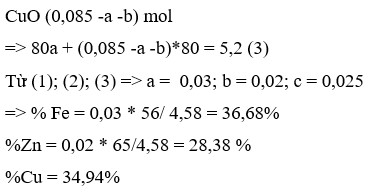Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Ta có: ![]()
Ta có: ![]()
Bảo toàn điện tích:

Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL:
Do vậy rắn Z chứa 0,038 mol Mg dư.
BTKL: ![]()
![]()

Đáp án D
nAgNO3 = 0,036 mol
nCu(NO3)2 = 0,024 mol
Xét cả quá trình phản ứng, ta thấy chỉ có Mg nhường e và Ag+, Cu2+ nhận e.
Bte: 2nMg pư = nAg+ + 2nCu2+ => nMg pư = (0,036 + 2.0,024):2 = 0,042 mol
=> nMg dư = 0,08 – 0,042 = 0,038 mol
Ta có: mX + mY = m + mAg + mCu + mMg dư => 4,21 + 4,826 = m + 0,036.108 + 0,024.64 + 0,038.24
=> m = 2,7 gam

Đáp án A
Gọi nZn = a; nFe = b thì nCu = a + b
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65a + 56b = 64(a+b) ⇔ a = 8b
Vậy phần trăm khối lượng cúa Zn trong hỗn hợp ban đầu là:
% m Z n = 65 . 8 b 65 . 8 b + 56 b . 100 % = 90 , 27 %

CuSO4 → KL pư hết.
Gọi: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\) ⇒ m = 65a + 56b (1)
BT e, có: 2a + 2b = 2nCu ⇒ nCu = a + b (mol) ⇒ m = 64(a + b) (2)
Từ (1) và (2) ⇒ 65a + 56b = 64a + 64b
⇒ a = 8b
\(\Rightarrow\%m_{Zn}=\dfrac{65a}{65a+56b}.100\%=\dfrac{65.8b}{65.8b+56b}.100\%\approx90,28\%\)