Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(\left\{{}\begin{matrix}n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\n_{HCl}=0,25\left(mol\right)\end{matrix}\right.\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,25}{2}\) \(\Rightarrow\) HCl còn dư, Kẽm p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{H_2}=0,1\left(mol\right)\\n_{HCl\left(dư\right)}=0,05\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=22,4\cdot0,1=2,24\left(l\right)\\m_{HCl\left(dư\right)}=0,05\cdot36,5=1,825\left(g\right)\end{matrix}\right.\)

Zn + 2HCl \(\rightarrow\) ZnCl2 + H2
nZn = \(\dfrac{6,5}{65}=0,1mol\)
nHCl = \(\dfrac{60.7,3\%}{36,5}=0,12mol\)
Lập tỉ lệ: nZn : nHCl = \(\dfrac{0,1}{1}:\dfrac{0,12}{2}=0,1:0,06\)
=> Zn dư
nZn dư = 0,1 - 0,06 = 0,04 mol
=> mZn dư = 0,04 . 65 = 2,6g
\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{60\cdot7.3}{100\cdot36.5}=0.12\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1...........2\)
\(0.1.........0.12\)
\(LTL:\dfrac{0.1}{1}>\dfrac{0.12}{2}\Rightarrow Zndư\)
\(n_{H_2}=\dfrac{0.12}{2}=0.06\left(mol\right)\)
\(V_{H_2}=0.06\cdot22.4=1.344\left(l\right)\)
\(m_{Zn\left(dư\right)}=\left(0.1-0.06\right)\cdot65=2.6\left(g\right)\)

a)\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
b)\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow Cu+H_2O\)
0,15 0,1 0 0
0,1 0,1 0,1 0,1
0,05 0 0,1 0,1
\(CuO\) dư và dư 0,05mol
\(\Rightarrow m_{CuOdư}=0,05\cdot80=4g\)
a.\(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,1 ( mol )
\(V_{H_2}=n_{H_2}.22,4=0,1.22,4=2,24l\)
b.\(n_{CuO}=\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,1 ( mol )
Chất còn dư là \(CuO\)
\(m_{CuO\left(du\right)}=n_{CuO\left(du\right)}.M_{CuO}=\left(0,15-0,1\right).80=4g\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\\ LTL:\dfrac{0,2}{1}< \dfrac{0,5}{2}\Rightarrow HCldư\\ n_{HCl\left(pứ\right)}=2n_{Zn}=0,4\left(mol\right)\\\Rightarrow m_{HCl\left(dư\right)}=\left(0,5-0,4\right).36,5=3,65\left(g\right)\\ b.n_{ZnCl_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,2.136=27,2\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4,=4,48\left(l\right)\\ d.3H_2+Fe_2O_3-^{t^o}\rightarrow2Fe+3H_2O \\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\ LTL:\dfrac{0,2}{3}< \dfrac{0,12}{1}\Rightarrow Fe_2O_3dưsauphảnứng\\ \Rightarrow n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{15}\left(mol\right)\\ \Rightarrow m_{Fe}=\dfrac{2}{15}.56=7,467\left(g\right)\)
a) n\(Zn\)=\(\dfrac{m}{M}\)=\(\dfrac{13}{65}\)=0,2(mol)
n\(HCl\)=\(\dfrac{m}{M}\)=\(\dfrac{18,25}{36,5}=\)0,5(mol)
PTHH : Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 0,5
Lập tỉ lệ mol : \(^{\dfrac{0,2}{1}}\)<\(\dfrac{0,5}{2}\)
n\(Zn\) hết , n\(HCl\) dư
-->Tính theo số mol hết
Zn + 2HCl->ZnCl\(2\) + H\(2\)
0,2 -> 0,4 0,2 0,2
n\(HCl\) dư= n\(HCl\)(đề) - n\(HCl\)(pt)= 0,5 - 0,4 = 0,1(mol)
m\(HCl\) dư= 0,1.36,5 = 3,65(g)
b) m\(ZnCl2\) = n.M= 0,2.136= 27,2 (g)
c)V\(H2\)=n.22,4=0,2.22,4=4,48(l)
d) n\(Fe\)\(2\)O\(3\)=\(\dfrac{m}{M}\)=\(\dfrac{19,2}{160}\)=0,12 (mol)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2 0,12
Lập tỉ lệ mol: \(\dfrac{0,2}{3}\)<\(\dfrac{0,12}{1}\)
nH2 hết .Tính theo số mol hết
\(HCl\)
3H2 +Fe2O3 → 2Fe + 3H2O
0,2-> 0,2
m\(Fe\)=n.M= 0,2.56= 11,2(g)

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{6,4}{160}=0,04\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,04}{1}< \dfrac{0,2}{3}\), ta được H2 dư.
Theo PT: \(n_{H_2\left(pư\right)}=3n_{Fe_2O_3}=0,12\left(mol\right)\Rightarrow n_{H_2\left(dư\right)}=0,2-0,12=0,08\left(mol\right)\)
\(\Rightarrow m_{H_2\left(dư\right)}=0,08.2=0,16\left(g\right)\)
Theo PT: \(n_{Fe}=2n_{Fe_2O_3}=0,08\left(mol\right)\Rightarrow m_{Fe}=0,08.56=4,48\left(g\right)\)

a, \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Ta có: \(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{Fe_2O_3}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Theo PT: \(n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=0,1\left(mol\right)\Rightarrow n_{Fe_2O_3\left(dư\right)}=0,3-0,1=0,2\left(mol\right)\)
\(\Rightarrow m_{Fe_2O_3}=0,2.160=32\left(g\right)\)

\( n_{Al}=\dfrac{2,7}{27}=0,1mol\)
\(n_{H_2SO_4}=\dfrac{24,5}{98}=0,25mol\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,1 0,25 0 0
0,1 0,15 0,05 0,15
0 0,1 0,05 0,15
Chất \(H_2SO_4\) dư và dư \(m=0,1\cdot98=9,8g\)
\(V_{H_2}=0,15\cdot22,4=3,36l\)
\(nAl=\dfrac{2,7}{27}=0,1\left(mol\right)\)
\(nH_2SO_4=\dfrac{24,5}{98}=0,25\left(mol\right)\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
0,1---->0,15------>0,05--------------->0,15
Xét tỉ lệ : \(\dfrac{0,1}{2}< \dfrac{0,25}{3}\)
=> H2SO4 dư vs pứ
\(nH_2SO_{4\left(dư\right)}=0,25-0,15=0,1\left(mol\right)\)
\(mH_2SO_4=\)\(0,1.98=9,8\left(g\right)\)
\(VH_2=0,15.22,4=3,36\left(lít\right)\)

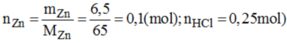
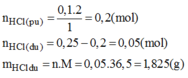

nZn=0,1 mol
nHCl=0,25 mol
Zn +2HCl=>ZnCl2+H2
Pứ 0,1 mol>=0,2 mol. =>0,1 mol
Dư 0,05 mol
VH2=2,24lit
HCl còn dư:0,05 mol
=>mHCl dư=1,825g