Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi công thức phân tử của hợp chất hữu cơ A là CXHYOZ
Ta có : %O =100-(60+ 13.33)=26.63%
Ta có ;
\(\frac{12x}{60}\)=\(\frac{y}{13.33}\)=\(\frac{16z}{26.67}\)=\(\frac{60}{100}\)= 0.6
do đó : x=\(\frac{60.0,6}{12}\)=3
y=0,6.13,33=8
z=\(\frac{26,67.0,6}{16}\)=1
vậy công thức phân tử của A là C3H8O.

%O = 100- (60 + 13,33) = 26,67
Gọi công thức hóa học của A là C x H y O z
Ta có tỷ lệ: x : y : z = 60/12 : 13,33/1 : 26,67/16 = 5 : 13,33 : 1,67 = 3 : 8 : 1
Công thức của hợp chất là C 3 H 8 O n
Ta có: (12.3+1.8+16)n=60
⇔ 60n= 60 → n=1
Vậy công thức phân tử của C x H y O z là C 3 H 8 O

mH=25%.16=4(g) -> nH=4/1=4(mol)
Hợp chất hữu cơ luôn có C -> Nguyên tố còn lại C -> mC=16-4=12(g)
=>nC=12/12=1(mol)
Vì: nC:nH=1:4 -> A: CH4 (Metan)

(a) Phản ứng nổ của TNT: 2C7H5N3O6 → 3N2 + 5H2O + 7CO + 7C
(b) 100 gam thuốc nổ Hexanit có chứa 60 gam TNT và 40 gam HND.
Số mol của từng chất là:
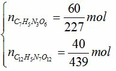
Áp dụng định luật bảo toàn nguyên tố ta có:
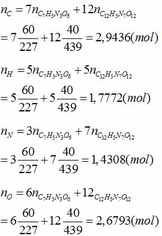
- Phần trăm khối lượng mỗi nguyên tố trong Hexanit:
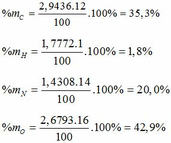
- Sản phẩm nổ của Hexanit là N2, H2O, CO, C
- Áp dụng định luật bảo toàn nguyên tố ta tính được số mol của các chất trong hỗn hợp sau khi nổ:
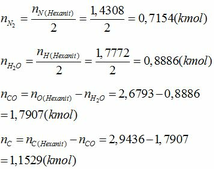
Phần trăm số mol của các chất trong hỗn hợp sau khi nổ:
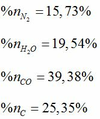

CTPT: CxHy
Có \(\%H=\dfrac{y}{12x+y}.100\%=25\%\)
=> y = 3x + 0,25y
=> \(0,75y=3x\)
=> \(\dfrac{x}{y}=\dfrac{1}{4}\)
=> CTPT: CH4

\(M_Z=\dfrac{5,05}{0,1}=50,5\left(g/mol\right)\)
\(m_{Cl}=\dfrac{50,5.70,3}{100}=35,5\left(g\right)\Rightarrow n_{Cl}=\dfrac{35,5}{35,5}=1\left(mol\right)\)
\(m_H=\dfrac{50,5.5,94}{100}=3\left(g\right)\Rightarrow n_H=\dfrac{3}{1}=3\left(mol\right)\)
\(m_C=50,5-35,5-3=12\left(g\right)\Rightarrow n_C=\dfrac{12}{12}=1\left(mol\right)\)
=> CTPT: CH3Cl
CTCT:



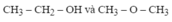
a, %C = 12n/(12n + 2n + 2) = 75%
=> n = 1
CTHH: CH4
b, CaHo ???