Người ta hòa 216,55 gam hỗn hợp muối KHSO4 và Fe(NO3)3 vào nước dư thu được dung dịch A. Sau đó cho m gam hỗn hợp B gồm Mg, Al, Al2O3 và MgO vào dung dịch A rồi khuấy đều tới khi các phản ứng xảy ra hoàn toàn thấy B tan hết, thu được dung dịch C chỉ chứa các muối và có 2,016 lít hỗn hợp khí D có tổng khối lượng là 1,84 gam gồm 5 khí ở (đktc) thoát ra trong đó về thể tích H2, N2O, NO2 lần lượt chiếm 4/9,1/9 và 1/9. Cho BaCl2 dư vào C thấy xuất hiện 356,49 gam kết tủa trắng. Biết trong B oxi chiếm 64/205 về khối lượng. Giá trị đúng của m gần nhất với
A.18.
B.20.
C.22
D.24



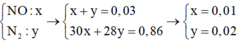
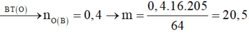
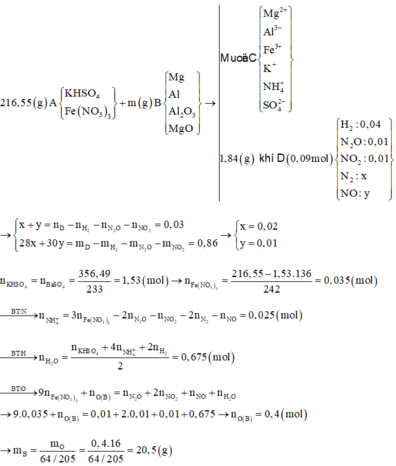

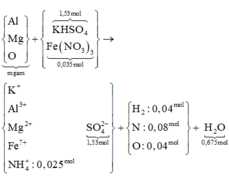

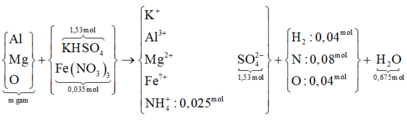

Tính số mol KHSO4 = BaSO4 = 1,53 mol
→Fe(NO3)3 =0,035 mol
Hai khí còn lại là NO và N2O, số mol là x, y.
Lập hệ phương trình về tổng khối lượng và số mol tìm được x = 0,01 và y = 0,02.
Bảo toàn N tính số mol NH4+ = 0,025 mol
Bảo toàn H tính số mol H2O = 0,675 mol
Bảo toàn O:
Suy ra nO (B) = 0,4 ⟶ mB = 6,4:64 / 205 = 20,5g
Đáp án B