Hỗn hợp NaCl và KCl (hỗn hợp A) tan trong nước thành dd. Thêm AgNO3 dư vào trong A thì thấy tách ra một lượng kết tủa bằng 229,6% so với lượng A. Tìm % mỗi chất trong A.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn lượng A = 100gam ( hoặc đặt số mol a,b rồi lập phương trình biểu diễn quan hệ giữa lượng A và lượng kết tủa, rút ra tỷ lệ a : b
ban oi cho mk hoi ra ti le nKCl/nNaCl=1/3 thi %KCl=25 con NaCl =75 ak

Gọi mhh = 100 (g) => m↓= 299,6 (g)
NaCl + AgNO3 ---> NaNO3 + AgCl ↓
--x------------------------------------x
KCl + AgNO3 ---> KNO3 + AgCl ↓
--y---------------------------------y
Ta có hệ PT:
58,5x + 74,5y = 100
143,5x + 143,5y = 229,6
=> x=1,2 ; y=0,4
=> mNaCl = 1,2 . 58,5 = 70,2 (g) => % mNaCl = \(\dfrac{70,2}{100}\) . 100% = 70,2 %
=> mKCl = 100% - 70,2% = 29,8%

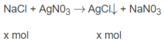
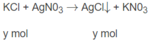
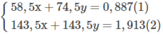
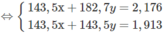
⇒ y = 6,71. 10 - 3 mol
Khối lượng KCl là : 74,5. 6,71. 10 - 3 = 0,5(g) KCl
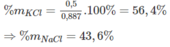

PTHH bạn tự viết nha.
Từ (1) và (2)->nCl- trong 50ml dd A=nAgCl=4.305:143.5=0.03mol
->500ml dd A có 0.03x500:50=0.3 mol Cl-
đặt nNaCl=amol;nKCl=bmol
Ta có hệ: 58.5a+74.5b=19.15
a+b=0.3
->a=0.2mol;b=0.1mol
->CM NaCl=0.2:0.5=0.4M
CM KCl=0.1:0.5=0.2M

Trong dd ban đầu:
K+_____a mol
Mg2+___b mol
Na+____c mol
Cl-_____a + 2b + c mol
mhhbđ = 74.5a + 95b + 58.5c = 24.625 g______(1)
nAgNO3 = 0.3*1.5 = 0.45 mol
Cho Mg vào A có phản ứng (theo gt) nên Ag(+) còn dư, Cl(-) hết. Rắn C gồm Ag và có thể cả Mg còn dư nữa. Thật vậy, khi cho rắn C vào HCl loãng thì khối lượng rắn bị giảm đi, chính do Mg pư, Ag thì không. Vậy mrắn C giảm = mMg chưa pư với A = 1.92 g.
=> nMg dư = 1.92/24 = 0.08 mol
=> nMg pư với A = 2.4/24 - 0.08 = 0.02 mol________(*)
Khi cho Mg vào A có pư:
Mg + 2Ag(+) ---> 2Ag(r) + Mg(2+)
0.02__0.04
=> nAg(+) pư với dd ban đầu = 0.45 - 0.04 = 0.41 mol
Ag(+) + Cl(-) ---> AgCl(r)
0.41___0.41
Có: nCl(-) = a + 2b + c = 0.41_____________(2)
Trong các cation trên, Mg(2+) và Ag(+) có pư với OH(-), tuy nhiên trong D chỉ có Mg(2+) nên kết tủa là Mg(OH)2:
Mg(2+) + 2OH(-) ---> Mg(OH)2
Khi nung:
Mg(OH)2 ---> MgO + H2O
Ta có: nMg(2+)trongD = nMgO = 4/40 = 0.1 mol
Trong đó 0.02 mol Mg(2+) được thêm vào bằng cách cho kim loại Mg vào (theo (*)), vậy còn lại 0.08 mol Mg(2+) là thêm từ đầu, ta có:
b = 0.08 mol_________________________(3)
(1), (2), (3) => a = 0.15, b = 0.08, c = 0.1
mKCl = 74.5*0.15 = 11.175 g
mMgCl2 = 95*0.08 = 7.6 g
mNaCl = 58.5*0.1 = 5.85 g

\(n_{Br_2}=0,5.2=1\left(mol\right)\\ C_2H_2+2AgNO_3+2NH_3\rightarrow Ag_2C_2+2NH_4NO_3\\ n_{Ag_2C_2}=\dfrac{96}{240}=0,4\left(mol\right)\\ n_{C_2H_2}=n_{Ag_2C_2}=0,4\left(mol\right)\Rightarrow m_{C_2H_2}=0,4.26=10,4\left(g\right)\\ \Rightarrow m_{hh\left(C_2H_4,C_2H_6\right)}=28-10,4=17,6\left(g\right)\\ C_2H_2+2Br_2\rightarrow C_2H_2Br_4\left(1\right)\\ C_2H_4+Br_2\rightarrow C_2H_4Br_2\left(2\right)\\ n_{Br_2\left(2\right)}=1-2.0,4=0,2\left(mol\right)\\ n_{C_2H_4}=n_{Br_2\left(2\right)}=0,2\left(mol\right)\\ m_{C_2H_4}=0,2.28=5,6\left(g\right)\\ m_{C_2H_6}=17,6-5,6=12\left(g\right)\\ hhA:\left\{{}\begin{matrix}C_2H_4:5,6\left(g\right)\\C_2H_6:12\left(g\right)\\C_2H_2:10,4\left(g\right)\end{matrix}\right.\)

chọn mAgNO3=100g
Gọi : nNaCl =xmol
nNaBr =ymol
x+y=100/170
143.5x+188y=100
=>x=360/1513 mol
y=530/1513mol
=>mNACl=360*68.5/ 1513 =13.92g
mNaBr=530*103/1513=36.08g
=>%NaCl=13.92*100(13.92+36.08)=27.8%
=> % NaBr =100-27,8=72,2%
cho e hỏi là níu mình chọn mAGNO3=100g thì đó là phần KL đủ đã tham gia phản ứng hay phần KL ban đầu (là phần Kl dư) v ?
+níu là phần đủ thì phần kết tủa sẽ bằng với mAgNO3 nhưng còn phần dư mà đề nói,,,là bnhiu?
+níu là phần KL ban đầu v thì KL phần kết tủa sẽ k bằng 100 đc ? giải thích hộ e vs, e hioe thắt mắt ![]()

