Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì khối lượng AgNO3 trong dung dịch giảm 17%.
a) Viết phương trình hoá học của phản ứng và cho biết vai trò các chất tham gia phản ứng.
b) Xác định khối lượng của vật sau phản ứng.


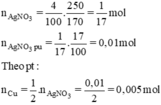


b)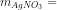
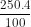 = 10 (gam)
= 10 (gam)
=>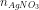 phản ứng =
phản ứng = 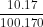 = 0,01 (mol)
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)